题目内容
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的( )
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、元素Z、W的简单离子的电子层结构不同 |
考点:原子结构与元素周期律的关系
专题:
分析:短周期元素X、Y、Z、W 的原子序数依次增大,Z 是地壳中含量最高的元素,则Z为O元素,X 的原子半径比Y 的小,则X不可能与Y处于同一周期,Y的原子序数小于氧元素,故Y处于第二周期,X处于第一周期,则X为H元素,X与W同主族,W原子序数大于氧元素,故W为Na元素,四原子最外层电子数之和为13,则Y原子的最外层电子数为13-1-1-6=5,故Y为N元素,据此解答.
解答:
解:短周期元素X、Y、Z、W 的原子序数依次增大,Z 是地壳中含量最高的元素,则Z为O元素,X 的原子半径比Y 的小,则X不可能与Y处于同一周期,Y的原子序数小于氧元素,故Y处于第二周期,X处于第一周期,则X为H元素,X与W同主族,W原子序数大于氧元素,故W为Na元素,四原子最外层电子数之和为13,则Y原子的最外层电子数为13-1-1-6=5,故Y为N元素,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>N>O,即r(W)>r(Y)>r(Z),故A错误;
B.由H、N、O三元素组成的化合物中,硝酸为共价化合物,硝酸铵为离子化合物,故B正确;
C.同周期自左而右非金属性增强,故非金属性O>N,非金属性越强气态氢化物越稳定,故氢化物稳定性H2O>NH3,故C错误;
D.元素O、Na的简单离子分别为O2-、Na+,核外电子数均为10,二者电子层结构相同,故D错误;
故选B.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>N>O,即r(W)>r(Y)>r(Z),故A错误;
B.由H、N、O三元素组成的化合物中,硝酸为共价化合物,硝酸铵为离子化合物,故B正确;
C.同周期自左而右非金属性增强,故非金属性O>N,非金属性越强气态氢化物越稳定,故氢化物稳定性H2O>NH3,故C错误;
D.元素O、Na的简单离子分别为O2-、Na+,核外电子数均为10,二者电子层结构相同,故D错误;
故选B.
点评:本题考查位置结构性质关系等,难度中等,推断元素是解题的关键,注意利用同周期原子半径大小关系确定X为氢元素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
近期我国提出控制温室气体排放的措施和近期指标,旨在“善待地球--科学发展”.下列不符合这一主题的是( )
| A、发展循环经济,构建资源节约型社会 |
| B、加高工厂的烟囱,使烟尘和废气远离地表,减少污染 |
| C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃 |
| D、采用“绿色化学”工艺,建立环境友好型化工体系 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性、它们在酸性溶液中还原性强弱顺序为Cl-<H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe2++I2=2Fe3++2I- |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、H2O2+SO2=H2SO4 |
有两种体积相同的某植物的营养液,其配方如下表所示:对于两种营养液的成分,下列说法中,正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量均不同 |
| D、各离子的物质的量完全相同 |
与8g SO3中氧原子数相同的是( )
| A、9.8g H2SO4 |
| B、6.6g CO2 |
| C、6.4g SO2 |
| D、6.72L CO(常温、常压) |
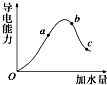 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: 表示的分子式
表示的分子式 中的含氧官能团的名称为
中的含氧官能团的名称为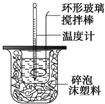 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: