题目内容
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4?7H2O的工艺流程如图1:(已知Cd的金属活动性介于Zn和Fe之间)

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 .该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除去重金属离子Cd2+,所用物质C为 .
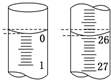
(5)取28.70g ZnSO4?7H2O加热至不同温度,剩余固体的质量变化如图2所示.680℃时所得固体的化
学式为 .
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4?H2O.

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为
(4)置换法除去重金属离子Cd2+,所用物质C为
(5)取28.70g ZnSO4?7H2O加热至不同温度,剩余固体的质量变化如图2所示.680℃时所得固体的化
学式为
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4?H2O.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4?7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4?7H2O;
(1)硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫;
(2)加入硫酸铁和硫酸是为了溶解氧化铁、硫化锌、硫化镉获得生产硫酸锌晶体和硫酸亚铁晶体的原料;其中硫酸铁氧化硫化锌;
(3)除铁是利用空气中氧气氧化亚铁离子生成FeOOH,在空气入口处设计了一个类似淋浴喷头的装置,依据增大物质接触面积会加快反应速率;
(4)依据置换反应的反应条件是活泼金属进行置换,结合制备实验方案是制取ZnSO4?7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间分析;
(5)28.70 g ZnSO4?7H2O的物质的量为0.1mol,分别分析生成ZnO、ZnSO4、ZnSO4?H2O的质量,进而确定温度.
(1)硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫;
(2)加入硫酸铁和硫酸是为了溶解氧化铁、硫化锌、硫化镉获得生产硫酸锌晶体和硫酸亚铁晶体的原料;其中硫酸铁氧化硫化锌;
(3)除铁是利用空气中氧气氧化亚铁离子生成FeOOH,在空气入口处设计了一个类似淋浴喷头的装置,依据增大物质接触面积会加快反应速率;
(4)依据置换反应的反应条件是活泼金属进行置换,结合制备实验方案是制取ZnSO4?7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间分析;
(5)28.70 g ZnSO4?7H2O的物质的量为0.1mol,分别分析生成ZnO、ZnSO4、ZnSO4?H2O的质量,进而确定温度.
解答:
解:闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4?7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4?7H2O;
(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,
故答案为:S;
(2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,
故答案为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S;
(3)除铁过程控制溶液的pH在5.4左右,利用空气中氧气氧化亚铁离子生成FeOOH,反应的两种方程式为:4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置是为了增大与空气的接触面积增大反应速率,
故答案为:4Fe2++O2+6H2O=4FeOOH+8H+;增大空气与溶液的接触面积,加快反应速率;
(4)制备实验方案是制取ZnSO4?7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,
故答案为:Zn;
(5)28.70 g ZnSO4?7H2O的物质的量为0.1mol,若得ZnSO4?H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃;据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b.
(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,
故答案为:S;
(2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,
故答案为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S;
(3)除铁过程控制溶液的pH在5.4左右,利用空气中氧气氧化亚铁离子生成FeOOH,反应的两种方程式为:4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置是为了增大与空气的接触面积增大反应速率,
故答案为:4Fe2++O2+6H2O=4FeOOH+8H+;增大空气与溶液的接触面积,加快反应速率;
(4)制备实验方案是制取ZnSO4?7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,
故答案为:Zn;
(5)28.70 g ZnSO4?7H2O的物质的量为0.1mol,若得ZnSO4?H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃;据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b.
点评:本题综合考查物质的制备、分离、提纯等知识,侧重于学生的分析能力、实验能力和计算能力的考查,把握物质性质是解题关键,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
有两种体积相同的某植物的营养液,其配方如下表所示:对于两种营养液的成分,下列说法中,正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量均不同 |
| D、各离子的物质的量完全相同 |
下列图象表达正确的是( )
A、 浓硫酸的稀释 |
B、 等量的盐酸与过量的锌粉反应 |
C、 氢气与氧气反应中的能量变化 |
D、 气态氢化物沸点 |
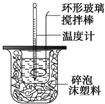 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: