题目内容
将0.1mol?L-1的醋酸溶液加水稀释,则( )
| A、中和此溶液所需的0.1 mol?L-1 NaOH溶液的体积增加 |
| B、c(CH3COOH)减小,平衡向电离方向移动,c(CH3COO-)增大 |
| C、平衡向电离方向移动,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均减小 |
| D、电离程度增大,由CH3COOH电离出的n(H+)变大 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:根据醋酸是弱电解质,则醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用温度与电离常数的关系确定氢氧根浓度的变化.
解答:
解:A、加水稀释不影响溶液中溶质的物质的量,中和所需NaOH物质的量不变,故A错误;
B、醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,故B错误;
C、醋酸溶液加水稀释,酸性减弱,氢氧根离子浓度增大,故C错误;
D、醋酸溶液中加水稀释将促进电离,离子的数目增多,故D正确;
故选D.
B、醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,故B错误;
C、醋酸溶液加水稀释,酸性减弱,氢氧根离子浓度增大,故C错误;
D、醋酸溶液中加水稀释将促进电离,离子的数目增多,故D正确;
故选D.
点评:本题考查弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.

练习册系列答案
相关题目
苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 |
| B、1mol苹果酸可与3mol NaOH发生中和反应 |
| C、1mol苹果酸与足量金属Na反应生成生成1mol H2 |
| D、苹果酸在一定条件下能发生缩聚反应 |
下列关于蛋白质的叙述中,不正确的是( )
| A、蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不再溶解 |
| B、人工合成的具有生命活力的蛋白质-结晶牛胰岛素是我国科学家在1965年首次合成的 |
| C、重金属盐能使蛋白质凝结,所以误食重金属盐会中毒 |
| D、浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了“颜色反应” |
已知:2M(g)?N(g);△H<0.现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如图所示.下列说法正确的是( )


| A、a、b、c、d四个点中处于平衡状态的点是a、b d |
| B、反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C、若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D、若40min后出现如图所示变化,则可能是加入了某种催化剂 |
反应:PCl5(g)?PCl 3(g)+Cl2(g) ①
2HI(g)?H2(g)+I2(g) ②
2NO2(g)?N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
2HI(g)?H2(g)+I2(g) ②
2NO2(g)?N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A、均不变 |
| B、均增大 |
| C、①增大,②不变,③减少 |
| D、①减少,②不变,③增大 |
C+CO2?2CO(正反应吸热),反应速率为v1:N2+3H2?2NH3(正反应放热),反应速率为v2.对于上述反应,当温度降低时,v1和v2的变化情况是( )
| A、同时增大 |
| B、同时减小 |
| C、v1增加,v2减小 |
| D、v1减小,v2增大 |
下列说法不正确的是( )
| A、在室内放置一些特别的绿色植物,可用于室内空气的净化 |
| B、合金的熔点一般高于各组成成分金属的熔点 |
| C、氢氧化钠溶液用盖橡胶塞的试剂瓶盛装 |
| D、工业上用盐酸刻蚀玻璃 |
有两种体积相同的某植物的营养液,其配方如下表所示:对于两种营养液的成分,下列说法中,正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量均不同 |
| D、各离子的物质的量完全相同 |
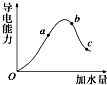 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: