题目内容
16.0.5L 1molL-1FeCl3溶液与0.1L 1molL-1MgCl2溶液中Cl-的数目之比( )| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
分析 根据溶液的浓度和化合物的组成判断两种溶液中离子浓度的关系,注意与溶液的体积无关,然后求出离子的物质的量,利用数目之比等于物质的量之比,由此分析解答.
解答 解:0.5L 1mol/L FeCl3溶液中c(Cl-)=3c(FeCl3)=3×1mol/L=3mol/L,n(Cl-)=0.5L×3mol/L=1.5mol;0.1L 1mol/L MgCl2溶液中c(Cl-)=2c(MgCl2)=2mol/L,n(Cl-)=0.L×2mol/L=0.2mol,所以数目之比等于1.5mol:0.2mol=15:2,
故选:C.
点评 本题考查的是物质的量浓度的相关计算,利用数目之比等于物质的量之比计算,题目难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
3.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
11.下列方程式书写正确的是( )
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
1.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
8.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是( )
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
5.为了防治病虫害,农民常对生长过程中的蔬菜喷洒农药.据有关专家介绍,用碱性溶液或清水浸泡冲洗蔬菜,可使残留在蔬菜上的农药毒性降低.因此,买来的蔬菜在食用前可用稀碱水或清水浸泡一段时间.则浸泡蔬菜时可加入适量的( )
| A. | 固体碳酸钠 | B. | 食醋 | C. | 白酒 | D. | 白糖 |
6.P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 ( )
| A. | NH3 | B. | HI | C. | SO2 | D. | CO2 |
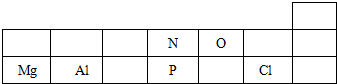
 .
.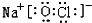 .
.