题目内容
19.下列说法中,正确的是( )①食盐灼烧时火焰呈黄色与久置的浓硝酸呈黄色原理不相同
②固体氢氧化钠存放在带塑料塞的广口瓶中
③熔点:钾>钠>钠钾合金
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡后溶液呈蓝色
⑤向含有Na+、SO42-、HCO3-、CO32-的溶液中加入过量的Na2O2固体,Na+和CO32-的物质的量不变
⑥1mol Na2O2与足量的水反应,转移的电子数为2mol
⑦取用金属钠时,应将剩下的大块钠放回原瓶,实验结束,余下的钠屑应用乙醇处理.
| A. | ①②⑦ | B. | ①②③⑥ | C. | ①②⑥⑦ | D. | ①②④⑤ |
分析 ①食盐灼烧时火焰呈黄色是因为Na元素焰色反应呈黄色;久置的浓硝酸呈黄色是因为溶解了红棕色二氧化氮气体;
②NaOH溶液能和二氧化硅反应生成黏性的硅酸钠;
③合金的熔点低于其任一成分的熔点;
④过氧化钠和水反应生成NaOH和氧气,其水溶液呈碱性,紫色石蕊试液遇碱变蓝色,但过氧化钠具有漂白性;
⑤向含有Na+、SO42-、HCO3-、CO32-的溶液中加入过量的Na2O2固体,过氧化钠和水反应生成NaOH和氧气,
碳酸氢根离子和NaOH反应生成CO32-;
⑥1mol Na2O2与足量的水反应,该反应中过氧化钠是氧化剂和还原剂,转移的电子的物质的量是1mol;
⑦钠和乙醇、氧气和水都反应.
解答 解:①食盐灼烧时火焰呈黄色是因为Na元素焰色反应呈黄色;久置的浓硝酸呈黄色是因为溶解了红棕色二氧化氮气体,所以食盐灼烧时火焰呈黄色与久置的浓硝酸呈黄色原理不相同,故正确;
②NaOH溶液能和二氧化硅反应生成黏性的硅酸钠而将试剂瓶玻璃塞黏住,应该用橡胶塞,故正确;
③合金的熔点低于其任一成分的熔点,所以熔点K、Na合金>Na>K,故错误;
④过氧化钠和水反应生成NaOH和氧气,其水溶液呈碱性,紫色石蕊试液遇碱变蓝色,但过氧化钠具有漂白性,导致溶液褪色,所以看到的现象是溶液先变蓝色后褪色,故错误;
⑤向含有Na+、SO42-、HCO3-、CO32-的溶液中加入过量的Na2O2固体,过氧化钠和水反应生成NaOH和氧气,
碳酸氢根离子和NaOH反应生成CO32-,所以导致溶液中Na+和CO32-的物质的量增大,故错误;
⑥1mol Na2O2与足量的水反应,该反应中过氧化钠是氧化剂和还原剂且各占一半,O元素化合价由-1价变为0价和-2价,所以转移的电子的物质的量是1mol,故错误;
⑦钠和乙醇、氧气和水都反应,且乙醇和钠反应比钠和水反应缓慢,所以实验结束,余下的钠屑应用乙醇处理,故正确;
故选A.
点评 本题考查化学实验评价,为高频考点,涉及离子反应、氧化还原反应、实验安全、试剂存放等知识点,侧重考查学生分析判断及计算能力,明确实验原理、物质性质是解本题关键,注意:过氧化钠具有漂白性,题目难度不大.

| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式2FeCl2+Cl2=2FeCl3.
(2)设计实验方案,完成下列表格.
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
| A. | 化学键是一种作用力 | |
| B. | 氢键也属化学键 | |
| C. | 化学键可以使离子相结合,也可以使原子相结合 | |
| D. | 化学方应过程中,反应物分子内的化学键断裂,生成物中的化学键形成 |
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
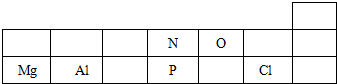
 .
.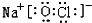 .
.