题目内容
15. 2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.| 温度/ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是0.08mol.
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法.
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是ac(填序号).
a. c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b. c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
c. c(NH4+)>c(SO32-)>c(OH-)>c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4.
a. 得到MnSO4的化学方程式是H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O.
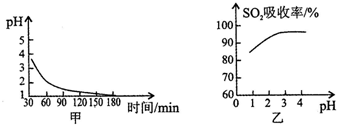
b.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙. 图甲中pH变化是因为吸收中有部分SO2被氧气氧化转化为H2SO4,生成H2SO4反应的化学方程式是2SO2+O2+2H2O=2H2SO4;由图乙可知pH的降低不利于SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是溶液中存在SO2+H2O?H2SO3?H++HSO3-,当溶液中酸性增强,平衡向左移动,使SO2气体从体系中逸出..
分析 (1)分析图表数据随温度升高二氧化硫转化率减小,平衡逆向进行,依据平衡原理分析判断反应热量变化;
(2)转化率=$\frac{消耗量}{起始量}$,平衡量=起始量-消耗量计算得到;
(3)①尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,依据溶液中物料守恒、电荷守恒、离子浓度大小比较依据分析判断选项;
②a.二氧化硫溶于水生成亚硫酸具有还原性,被二氧化锰氧化为硫酸,二氧化锰被还原为锰离子;
b.二氧化硫被氧化为硫酸溶液PH减小,依据图象分析PH增大有利于二氧化硫的吸收,酸性越强越有利于二氧化硫逸出.
解答 解:(1)图表数据随温度升高二氧化硫转化率减小,平衡逆向进行,逆反应为吸热反应,正反应为放热反应,
故答案为:放热;
(2)400℃,1.01×105Pa时,将含10mol SO2的原料气通入一密闭容器中进行反应,转化率=99.2%,平衡时SO2的物质的量=10mol-10mol×99.2%=0.08mol,
故答为:0.08;
(3)①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,
a.溶液中氮元素和硫元素遵循物料守恒,氮元素物质的量和硫元素物质的量之比为2:1,c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],故a正确;
b.溶液中存在电荷守恒,c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故b错误;
c.弱碱性的(NH4)2SO3溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(H+),故c正确;
故答案为:ac;
②a.二氧化硫溶于水生成亚硫酸具有还原性,被二氧化锰氧化为硫酸,二氧化锰被还原为锰离子,用MnO2与水的悬浊液吸收上述尾气并生产MnSO4,反应的化学方程式为:H2O+SO2=H2SO3 MnO2+H2SO3=MnSO4+H2O;
故答案为:H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O;
b.图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式为:2SO2+O2+2H2O=2H2SO4,二氧化硫被氧化为硫酸溶液PH减小,依据图象分析PH增大有利于二氧化硫的吸收,酸性越强越有利于二氧化硫逸出,由图乙可知pH的降低,酸性增强,抑制亚硫酸电离,促进亚硫酸分解,溶液中存在SO2+H2O?H2SO3?H++HSO3-,当溶液中酸性增强,平衡向左移动,使SO2气体从体系中逸出;
故答案为:2SO2+O2+2H2O=2H2SO4;不利于;溶液中存在SO2+H2O?H2SO3?H++HSO3-,当溶液中酸性增强,平衡向左移动,使SO2气体从体系中逸出.
点评 本题考查了化学平衡影响因素分析,平衡计算,电解质溶液中电荷守恒、物料守恒、离子浓度大小比较,氧化还原反应原理的分析应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Fe3+→Fe2+ | B. | Zn→Zn2+ | C. | H2→H2O | D. | Cl2→Cl- |
(1)甲同学使用的是酸式滴定管,乙同学使用的是碱式滴定管.
(2)甲同学的滴定管在用蒸馏水洗净后没有用标准盐酸润洗,乙同学的滴定管在用蒸馏水洗净后也没有用待测NaOH 溶液润洗,其余操作均正确,这样甲同学测定结果偏大(偏大、偏小、无影响,下同),乙同学测定结果偏小.
(3)乙同学选择酚酞作指示剂进行试验,如何来判断滴定终点:滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为粉红色,且30秒内不褪色
(4)甲同学根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
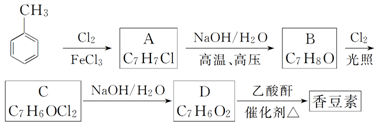
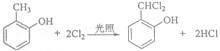 ;
;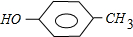 和
和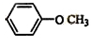 .
.