题目内容
3.化学反应原理在科研和工农业生产中有广泛应用.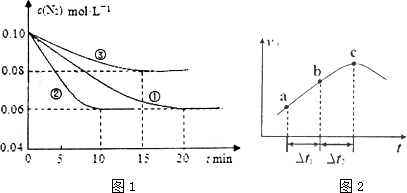
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)?2NH3(g)△H<0.在lL密闭容器中加入0.1mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如图1所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=0.008mol•L-1•min-1;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的e、b(填字母编号).
a.增大压强 b.减小压强 C.升高温度d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)?N2O4(g).
①T℃时,将0.40mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol•L-1,则该反应的平衡常数K=5L•mol-1;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图2所示.下列说法正确的是C(填字母编号).
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.△t1=△t2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol•L-1的氨水与b mol•L一1盐酸等体积混合,反应后溶液恰好显中性,则a>b(填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{{b×{{10}^{-7}}}}{a-b}mol•{L^{-1}}$.
分析 (1)根据v=$\frac{△c}{△t}$计算反应速率,根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,①和③比较可知,③的速率比①小,平衡时氮气的浓度高,即平衡逆向移动,故③减小了压强;
(2)①根据反应方程式,利用平衡常数的定义计算;
②根据温度对平衡常数的影响判断;
③向绝热密闭容器中通入一定量的NO2,根据图象可知,反应开始反应物浓度最大,但反应速率逐渐增大,据此判断;
(3)当a=b时,amol•L-1的氨水与b mol•L-1盐酸等体积混合,反应后溶液呈酸性,若溶液显中性,则酸的量要减少,故a>b,根据氨水的电离平衡常数的定义可计算电离平衡常数.
解答 解:(1)根据像可知,②在10min时达到平衡,此时氮气的浓度变化为0.04mol/L,根据方程式或知,氨气的浓度变化了0.08mol/L,根据v=$\frac{△c}{△t}$可知v(NH3)=$\frac{0.08mol/L}{10min}$=0.008mol•L-1•min-1,根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,故选e,①和③比较可知,③的速率比①小,平衡时氮气的浓度高,即平衡逆向移动,故③升减小了压强,故选b,
故答案为:0.008mol•L-1•min-1;e;b;
(2)①2 NO2(g)?N2O4(g)
起始时 0.2mol•L-1 0
转化 0.1mol•L-1 0.05mol•L-1
平衡时 0.1mol•L-1 0.05mol•L-1
故平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.05}{0.{1}^{2}}$L•mol-1=5L•mol-1,
故答案为:5L•mol-1;
②温度升高,此平衡向逆反应方向移动,K值减小,
故答案为:减小;
③反应开始反应物浓度最大,但反应速率逐渐增大,说明反应为放热反应,
A.c点反应速率最大,但没有达到平衡状态,反应继续向正反应方向进行,c点时转化率不是最大,错误;
B.反应向正反应进行,随着反应的进行,反应物浓度逐渐降低,故错误;
C、随反应的进行,体系是的温度越来越高,反应速率逐渐增大,当时间相同时,转化率逐渐增大,正确,
故答案为:C;
(3)当a=b时,amol•L-1的氨水与b mol•L一1盐酸等体积混合,反应后溶液呈酸性,若溶液显中性,则酸的量要减少,故a>b.
反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据电荷守恒溶液中c(NH4+)=c(Cl-)=$\frac{b}{2}$mol/L,反应前c(NH3•H2O)=$\frac{a}{2}$mol/L,
则反应后一水合氨的浓度为:c(NH3•H2O)=(a/2-b/2)mol/L,所以氨水的电离平衡常数为:K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$═$\frac{b×1{0}^{-7}}{a-b}$mol/L;
故答案为:>;$\frac{{b×{{10}^{-7}}}}{a-b}mol•{L^{-1}}$.
点评 本题主要考查了物质的量或浓度随时间的变化曲线、化学平衡常数的含义、化学平衡的影响因素、化学反应速率的影响因素、酸碱混合时的定性判断及有关平衡常数的计算,中等难度,答题时注意电解质溶液基础知识的灵活运用.

 高中必刷题系列答案
高中必刷题系列答案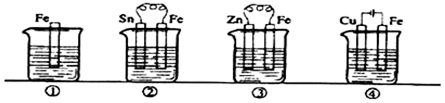
| A. | ③>②>④>① | B. | ④>②>①>③ | C. | ②>①>③>④ | D. | ④>②>③>① |
 2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.| 温度/ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是0.08mol.
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法.
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是ac(填序号).
a. c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b. c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
c. c(NH4+)>c(SO32-)>c(OH-)>c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4.
a. 得到MnSO4的化学方程式是H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O.
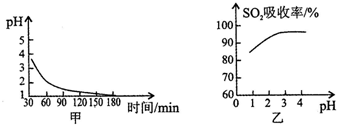
b.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙. 图甲中pH变化是因为吸收中有部分SO2被氧气氧化转化为H2SO4,生成H2SO4反应的化学方程式是2SO2+O2+2H2O=2H2SO4;由图乙可知pH的降低不利于SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是溶液中存在SO2+H2O?H2SO3?H++HSO3-,当溶液中酸性增强,平衡向左移动,使SO2气体从体系中逸出..
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |
| A. | c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-) | B. | c(OH-)=c(HS-)+c(H+)+2c(H2S) | ||
| C. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | D. | c(OH-)=c(HS-)+c(H+)+c(H2S) |
