题目内容
3.等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸充分反应,其中( )| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |
分析 由方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,产生的CO2一样多;与盐酸反应,碳酸钠要2步:先碳酸根与氢离子反应生成碳酸氢根,然后碳酸氢根和氢离子反应生成二氧化碳,即CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑;而碳酸氢钠与盐酸反应生成二氧化碳只需1步,即HCO3-+H+═H2O+CO2↑,所以反应生成二氧化碳速率碳酸氢钠的快.
解答 解:A、根据方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,放出的二氧化碳的物质的量相同,故A错误;
B、碳酸钠和碳酸氢钠物质的量相同,与足量盐酸反应放出的二氧化碳相同,故B错误;
C、碳酸钠与盐酸反应分别进行,先生成碳酸氢钠,然后碳酸氢钠才能和氢离子反应生成二氧化碳;而碳酸氢钠直接与盐酸反应生成二氧化碳,所以碳酸氢钠与盐酸反应放出的二氧化碳速度快,故C错误;
D、根据CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑可知,碳酸氢钠放出二氧化碳的速率快,故D正确;
故选D.
点评 本题考查了碳酸氢钠、碳酸钠的化学性质,题目难度不中等,要求学生熟练掌握碳酸钠、碳酸氢钠的化学性质,试题基础性强,侧重对学生基础知识的巩固和训练,意在巩固学生的基础,提高学生的分析、理解能力.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 制取氯乙烷(CH3一CH2Cl)的最好的方法是乙烷与氯气发生取代反应 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
11.用含有A1203.SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩.结晶.分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩.结晶.分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
8.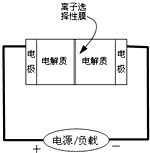 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )| A. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.2mol电子 | |
| B. | 放电过程中钠离子从右到左通过离子交换膜 | |
| C. | 电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充电过程中钠离子从右到左通过离子交换膜 |
15.K2Cr2O7+14HCl (浓)═2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6mol/L)反应,MnO2需和浓盐酸(>8mol/L)反应.根据以上信息,下列结论中不正确的是( )
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
12.向含有1molFeCl2的溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+恰好全部被氧化为Fe3+,并使X2O72-还原为X3+,则n值为( )
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
13.下列反应中,HCl只作还原剂的是( )
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |