题目内容
14.现有如下两个反应:A.NaOH+HCl═NaCl+H2O
B.Cu+2Ag+═2Ag+Cu2+
(1)根据两反应本质,判断能否设计成原电池A不能,B能.
(2)如果不能,说明其原因A为非氧化还原反应,没有电子的转移.
(3)如果可以,则写出正、负极材料、其电极反应式、反应类型(“氧化反应”或“还原反应”):
负极:Cu,Cu-2e-=Cu2+,氧化反应.
正极:Ag(石墨、Pt、等只要比Cu不活泼且能导电即可),2Ag++2e-═2Ag,还原反应.
分析 (1)能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应,否则不能设计成原电池;
(2)非氧化还原反应不能设计成原电池;
(3)根据Cu+2Ag+═2Ag+Cu2+可知Fe应为负极,失电子被氧化,正极可为C、Ag等,正极上Ag+得电子生成Ag,电解质溶液含有Ag+.
解答 解:(1)A.该反应不是氧化还原反应,所以不能设计成原电池,B.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,
故答案为:A不能,B能;
(2)A.NaOH+HCl═NaCl+H2O该反应中各元素的化合价不变,属于复分解反应,所以不是氧化还原反应,则不能设计成原电池,
故答案为:A为非氧化还原反应,没有电子的转移;
(3)Cu+2Ag+=Cu2++2Ag,根据反应前后的金属单质确定电极材料,所以该原电池的电极材料是铜和碳,铜易失去电子发生氧化反应,所以铜作负极,电极反应式为:Cu-2e-=Cu2+,Ag(石墨、Pt、等只要比Cu不活泼且能导电即可)作正极发生还原反应,2Ag++2e-=2Ag;
故答案为:铜;Cu-2e-=Cu2+;氧化反应;Ag(石墨、Pt、等只要比Cu不活泼且能导电即可);2Ag++2e-=2Ag;还原反应.
点评 本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大.
注意原电池的设计:
1、基本方法
以氧化还原反应为基础,确定原电池的正负极、电解质溶液及电极反应,可参考锌-铜-稀硫酸原电池模型处理问题.其方法是还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.
2、电解质溶液的选择
电解质溶液一般要能与负极发生反应,或者是电解质溶液中溶解的其它物质与负极发生反应.
3、电极材料的选择
电极材料必须导电,负极必须能够与电解质溶液反应,容易失去电子;正极和负极之间只有产生电势差,电子才能定向运动,所以正极和负极不用同一种材料.

| A. | 直接排放工业废气 | B. | 改进汽车尾气净化技术 | ||
| C. | 采用焚烧方法处理垃圾 | D. | 过度开采和使用化石燃料 |
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正化合价 (或最低负化合价) | -4 | +4 |
(2)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为NH3+HNO3═NH4NO3.
(3)B的单质与D的最高价氧化物对应的水化物在加热条件下发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O.
(4)C单质与Al具有某些相似性,比如能与强碱反应,写出C单质与NaOH溶液反应的化学方程式:Si+2NaOH+H2O═Na2SiO3+2H2↑.
(5)A、B、C、D均可形成分子中含18电子的氢化物,这些氢化物的分子式分别为H2S、C2H6、SiH4、N2H4.
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
| A. |  | B. |  | C. |  | D. |  |
| A. | 最外层电子数呈周期性变化 | B. | 元素的相对原子质量逐渐增大 | ||
| C. | 核电荷数逐渐增大 | D. | 核外电子排布呈周期性变化 |
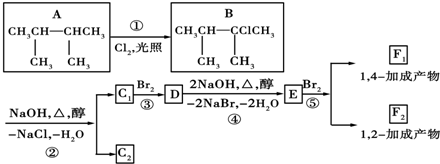
 .
. ;F1的结构简式是
;F1的结构简式是 .F1与F2的关系为同分异构体.
.F1与F2的关系为同分异构体.