题目内容
13.pH=14的氢氧化钡溶液,它的物质的量浓度c=0.5mol/L.分析 pH=14的氢氧化钡溶液中,c(H+)=10-14mol/L,求出c(OH-)=$\frac{Kw}{c({H}^{+})}$,然后根据c(Ba(OH)2)=$\frac{1}{2}$c(OH-)来计算.
解答 解:pH=14的氢氧化钡溶液中,c(H+)=10-14mol/L,故溶液中的c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-14}}$=1mol/L,而由于氢氧化钡为二元强碱,故c(Ba(OH)2)=$\frac{1}{2}$c(OH-)=$\frac{1}{2}$×1mol/L=0.5mol/L,故答案为:0.5mol/L.
点评 本题考查了一定pH溶液中溶质的物质的量浓度的计算,难度不大,应注意到氢氧化钡为二元强碱.

练习册系列答案
相关题目
1.已知酸性: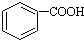 >H2CO3>
>H2CO3>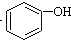 ,将
,将 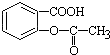 转变为
转变为 的方法是( )
的方法是( )
 >H2CO3>
>H2CO3> ,将
,将  转变为
转变为 的方法是( )
的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| C. | 加热溶液,通入足量的CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaHCO3溶液 |
8.下列关于油脂的说法正确的是( )
| A. | 甘油是油脂的一种 | |
| B. | 油脂中均含有酯基 | |
| C. | 油脂不能发生取代反应 | |
| D. | 油脂在酸性条件下的水解程度比碱性条件下大 |
18.下列说法正确的是( )
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
5.某烃的一种同分异构体,一氯代产物只有一种,则该烃的分子式可能为( )
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
13.下列说法中,正确的是( )
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题: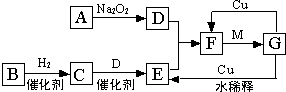 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图(部分产物和反应条件已略去),其中A、B、D在常温下均为无色、无刺激性气味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图(部分产物和反应条件已略去),其中A、B、D在常温下均为无色、无刺激性气味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.