题目内容
8.Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列说法中,错误的是( )| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
分析 A.根据正极反应式知,锂作负极,负极上Li失电子发生氧化反应;
B.负极电极方程与正极电极方程相加即得到电池的电池反应式;
C.充电时,阴极上电极反应式与原电池负极电极反应式正好相反;
D.原电池放电时,阳离子向正极移动.
解答 解:A.锂作负极,负极上锂失电子发生氧化反应,所以电极反应式为Li-e-=Li+,故A正确;
B.负极电极反应式为Li-e-=Li+,正极的反应式为:2Li++FeS+2e-=Li2S+Fe,则该电池的电池反应式为:2Li+FeS=Li2S+Fe,故B正确;
C.充电时,阴极上电极反应式与原电池负极电极反应式正好相反,阴极上电极反应式为Li++e-=Li,故C错误;
D.放电时,阳离子向正极移动,即锂离子向正极移动,故D正确;
故选C.
点评 本题考查了化学电源新型电池,根据原电池原理来分析解答,知道电极上发生的反应及离子移动方向即可解答,电极反应式的书写是学习难点,总结归纳书写规律,难度中等.

练习册系列答案
相关题目
18.下列实验中,不能观察到明显现象的是( )
| A. | 把氯气通入到FeSO4溶液中 | |
| B. | 把一段打磨过的铝条放入少量冷水中 | |
| C. | 向饱和Na2CO3溶液通入足量的CO2 | |
| D. | 把溴水滴加到KI淀粉溶液中 |
19.下列化学用语的表达正确的是( )
| A. | KCl电离方程式:KCl=K++Cl- | B. | 光导纤维主要成分的化学式:Si | ||
| C. | 中子数为20的氯原子:1720Cl | D. | S2-的结构示意图: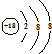 |
16.下列离子组合,能够大量共存的是( )
| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | 强碱性溶液中:Na+、NO3-、HCO3-、SO32- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
3.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A. | 其它条件不变,若升高温度,X的体积分数增大,则该反应的正反应△H>0 | |
| B. | 其它条件不变,将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其它条件不变,若增大压强,则物质Y的转化率减小 | |
| D. | 以X浓度变化表示的反应速率为0.001mol•L-1•s-1 |
13.若NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | NA个氧气分子与NA个氖气分子的质量比是8:5 | |
| D. | 标准状况下,11.2 L CO2与常温常压下8.5 g NH3所含分子数相等 |
20.一定温度下,取pH=12的NaOH溶液和氨水各10mL,分别用蒸馏水冲稀至1L.关于稀释后的溶液的pH的说法正确的是( )
| A. | NaOH溶液的pH小于氨水的pH | B. | NaOH溶液的pH大于氨水的pH | ||
| C. | 两溶液的pH相等 | D. | 无法判别两溶液pH的相对大小 |
17.下列物质都含有羟基(-OH),各羟基中氢原子的活性大小比较正确的是( )
①H2O ②H2SO4(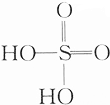 ) ③C2H5OH ④CH3COOH.
) ③C2H5OH ④CH3COOH.
①H2O ②H2SO4(
 ) ③C2H5OH ④CH3COOH.
) ③C2H5OH ④CH3COOH.| A. | ①>②>③>④ | B. | ②>③>④>① | C. | ②>④>①>③ | D. | ④>③>②>① |
16.下列化学用语正确的是( )
| A. | 次氯酸钙的化学式:CaClO | |
| B. | 氟离子结构示意图: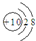 | |
| C. | 质量数为127的钡原子:127Ba | |
| D. | 硫酸的电离方程式:H2SO4═2H+SO${\;}_{4}^{2-}$ |