题目内容
16.下列离子组合,能够大量共存的是( )| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | 强碱性溶液中:Na+、NO3-、HCO3-、SO32- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
分析 A.离子之间结合生成络离子;
B.该组离子之间不反应;
C.强碱溶液中含大量的氢氧根离子;
D.强酸溶液中该组离子之间发生氧化还原反应.
解答 解:A.Fe3+、SCN-结合生成络离子,不能共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.溶液显碱性,不能大量存在HCO3-,故C错误;
D.酸性溶液中H+、Fe2+、NO3-发生氧化还原反应,不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列物质中,一定由三种元素组成的是( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
7.下列说法不正确的是( )
| A. | 用FeCl3溶液检验苯中是否含有苯酚 | |
| B. | 用新制的Cu(OH)2鉴别乙醛、乙酸、乙醇 | |
| C. | 用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基 | |
| D. | 用溴水可鉴别苯、溴乙烷和庚烯 |
4.给定条件下,下列选项中所示的物质间转化能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | B. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | ||
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{20}}{→}$H2SO4 |
11.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A. | Cl2+H2O?H++Cl-+HClO | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | H2S?H++HS- | D. | NH4++2H2O?NH3•H2O+H3O+ |
8.Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列说法中,错误的是( )
| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
5.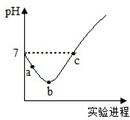 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| C. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| D. | 由a点到b点的过程中,溶液中$\frac{c(Cl{O}^{-})}{c({H}^{+})}$增大 |
4. 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
(1)仅依据K的变化可推断出随着卤素原子核电荷数的增加cd(填字母)
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
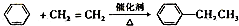
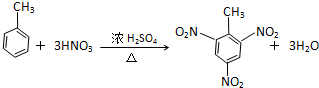 .
. .
.