题目内容
17.下列物质都含有羟基(-OH),各羟基中氢原子的活性大小比较正确的是( )①H2O ②H2SO4(
 ) ③C2H5OH ④CH3COOH.
) ③C2H5OH ④CH3COOH.| A. | ①>②>③>④ | B. | ②>③>④>① | C. | ②>④>①>③ | D. | ④>③>②>① |
分析 Na与①H2O ②H2SO4( ) ③C2H5OH ④CH3COOH都能反应生成氢气,反应生成氢气快慢取决于羟基中H原子的活泼性,这几种电解质电离出氢离子越容易,即物质的酸性越强,则与钠反应生成氢气速率越快,据此分析解答.
) ③C2H5OH ④CH3COOH都能反应生成氢气,反应生成氢气快慢取决于羟基中H原子的活泼性,这几种电解质电离出氢离子越容易,即物质的酸性越强,则与钠反应生成氢气速率越快,据此分析解答.
解答 解:物质是酸性越强,其电离出氢离子越容易,则与钠反应生成氢气速率越快,电离出氢离子难易顺序为H2SO4>CH3COOH>H2O>C2H5OH,则反应生成氢气的速率排列顺序为②>④>①>③,
故选C.
点评 本题考查钠的化学性质,明确反应速率快慢与物质电离出氢离子难易程度是解本题关键,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
7.下列说法不正确的是( )
| A. | 用FeCl3溶液检验苯中是否含有苯酚 | |
| B. | 用新制的Cu(OH)2鉴别乙醛、乙酸、乙醇 | |
| C. | 用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基 | |
| D. | 用溴水可鉴别苯、溴乙烷和庚烯 |
8.Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列说法中,错误的是( )
| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
5.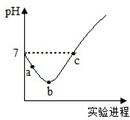 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| C. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| D. | 由a点到b点的过程中,溶液中$\frac{c(Cl{O}^{-})}{c({H}^{+})}$增大 |
12.已知硝酸钾的溶解度随温度的升高而增大,下列叙述正确的是( )
| A. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均增大 | |
| B. | 把60℃的硝酸钾饱和溶液降温到30℃,溶液仍饱和,溶液的质量分数和物质的量浓度均不变 | |
| C. | 60℃硝酸钾饱和溶液中含有的溶质的质量比30℃的硝酸钾饱和溶液中多 | |
| D. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均不变 |
2.在实验室中不宜用硫酸制备( )
| A. | 氢气 | B. | 二氧化碳 | C. | 氯化氢 | D. | 硫化氢 |
7.下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
⑤分子式为C3H6与C6H12的两种有机物一定互为同系物
⑥互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数)
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
⑤分子式为C3H6与C6H12的两种有机物一定互为同系物
⑥互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数)
| A. | 只有①②③④ | B. | 只有①②③④⑤ | C. | 只有②③④ | D. | 只有①②③ |
4. 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
(1)仅依据K的变化可推断出随着卤素原子核电荷数的增加cd(填字母)
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
5.下列有关化学用语表示正确的是( )
| A. | 羟基的电子式: | B. | 聚丙烯的结构简式: | ||
| C. | 丙烷分子的比例模型为: | D. | 邻羟基苯甲酸的结构简式: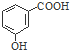 |