题目内容
3.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )| A. | 其它条件不变,若升高温度,X的体积分数增大,则该反应的正反应△H>0 | |
| B. | 其它条件不变,将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其它条件不变,若增大压强,则物质Y的转化率减小 | |
| D. | 以X浓度变化表示的反应速率为0.001mol•L-1•s-1 |
分析 A、升高温度化学平衡向吸热的方向移动;
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、增大压强平衡向气体体积减小的方向移动;
D、根据达到平衡时生成的0.3mol的Z,可以计算出Z的浓度,得出60s内Z的反应速率,再根据不同物质反应速率之比等于计量数之比,得出答案.
解答 解:A、X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故A错误;
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的$\frac{1}{2}$,但是平衡向左移动,Z浓度小于原来的$\frac{1}{2}$,故B错误;
C、增大压强,平衡向气体体积减小的正反应方向移动,Y的转化率增大,故C错误;
D、c(Z)=$\frac{0.3mol}{10L}$=0.03mol/L,所以v(Z)=$\frac{0.03mol/L}{60s}$=0.0005mol/(L•s),故v(X)=2v(Z)=0.001 mol•L-1•s-1,故D正确.
故选D.
点评 考查外界条件温度、浓度、压强对化学平衡的影响,要求学生能根据题目所给的各种条件改变,来判断化学平衡移动的方向,题目难度中等.

练习册系列答案
相关题目
13.对于0.1mol•L-1(NH4)2SO4溶液,不正确的是( )
| A. | c(NH4+)>c(SO42-) | B. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | ||
| C. | c(NH4+)+c(H+)=c(SO42-)+c(OH-) | D. | 加入少量NaOH固体,c(NH4+)增大 |
11.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A. | Cl2+H2O?H++Cl-+HClO | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | H2S?H++HS- | D. | NH4++2H2O?NH3•H2O+H3O+ |
18.化学中常借助曲线图来表示某种变化过程,如①平衡移动过程、②中和滴定过程、③沉淀的生成和溶解、④固体物质的溶解度变化过程等,下列曲线图中从左到右依次表示上述过程中的( )


| A. | ①②③④ | B. | ②③①④ | C. | ④③②① | D. | ②①③④ |
8.Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列说法中,错误的是( )
| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
15.下列说法不正确的是( )
| A. | Al2O3的熔点高,可用作耐火材料 | |
| B. | NaHCO3与盐酸反应,可用于治疗胃酸过多 | |
| C. | SO2可污染环境,不可用于杀菌、消毒 | |
| D. | 二氧化氮、氨气、氯气和二氧化硫都是易液化的气体 |
12.已知硝酸钾的溶解度随温度的升高而增大,下列叙述正确的是( )
| A. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均增大 | |
| B. | 把60℃的硝酸钾饱和溶液降温到30℃,溶液仍饱和,溶液的质量分数和物质的量浓度均不变 | |
| C. | 60℃硝酸钾饱和溶液中含有的溶质的质量比30℃的硝酸钾饱和溶液中多 | |
| D. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均不变 |
11.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 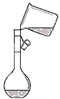 是向容量瓶转移溶液 | |
| B. | 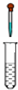 制取氢氧化亚铁 | |
| C. | 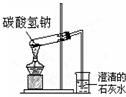 是碳酸氢钠受热分解 | |
| D. | 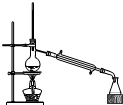 分离四氯化碳(沸点76.75℃)和甲苯(沸点为110.6℃)的混合物 |
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.反应时释放大量热并快速产生大量气体.已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol.又知:H2O(g )=H2O (l)△H=-44kJ•mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为712kJ.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.反应时释放大量热并快速产生大量气体.已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol.又知:H2O(g )=H2O (l)△H=-44kJ•mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为712kJ.