题目内容
2.已知 25℃下时,NH3•H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11. 25℃时有关NH4HCO3溶液的说法中正确的是( )| A. | 呈弱酸性 | |
| B. | c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3) | |
| C. | 滴入NaOH 溶液发生反应:NH4++OH-=NH3•H2O和HCO3-+OH-=H2O+CO32- | |
| D. | 滴入NaOH溶液,则$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 |
分析 A.由电离平衡常数可知NH3•H2O 电离程度比H2CO3大,电离程度小的,对应离子水解程度大;
B.结合电荷守恒和物料守恒判断;
C.滴入NaOH,NH4+、HCO3-都可与OH-反应;
D.$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$分子分母同乘以c(OH-),为NH3•H2O的电离常数与Kw的比值,以此判断.
解答 解:A.由电离平衡常数可知NH3•H2O 电离程度比H2CO3大,则HCO3-水解程度比NH4+大,溶液呈酸性,故A错误;
B.c(OH-)+c(HCO3-)+2c(CO32-)=c(NH4+)+c(H+),c(NH4+)+c(NH3•H2O)=c(CO32-)+c(HCO3-)+c(H2CO3),二者联式可得c(OH-)+c(CO32-)+c(NH3•H2O)=c(H2CO3)+c(H+),故B错误;
C.滴入NaOH,NH4+、HCO3-都可与OH-反应,反应的离子方程式为NH4++OH-=NH3•H2O和HCO3-+OH-=H2O+CO32-,故C正确;
D.$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$分子分母同乘以c(OH-),为NH3•H2O的电离常数与Kw的比值,只与温度有关,加入NaOH,比值不变,故D错误.
故选C.
点评 本题综合考查弱电解质的电离以及盐类的水解,为高频考点,侧重考查学生的分析能力,注意把握离子浓度比较的角度以及电离常数的应用,难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
11.在铁的氧化物和氧化铝组成的混合物中,加入 2mol/L 硫酸溶液 65mL,恰好完全反应,所得溶液中Fe2+能被标准状况下 112mL 氯气氧化.则原混合物中金属元素和氧元素的原子个数之比为( )
| A. | 9:13 | B. | 5:7 | C. | 4:3 | D. | 3:4 |
13.下列有关苯乙烯(  )的说法错误的是( )
)的说法错误的是( )
 )的说法错误的是( )
)的说法错误的是( )| A. | 苯乙烯与乙烯互为同系物 | B. | 所有原子可能在同一平面 | ||
| C. | 可使酸性KMnO4溶液褪色 | D. | 可发生加成反应 |
10.某同学用Na2CO3和NaHCO3溶液进行如图所示实验.下列说法中,正确的是( )


| A. | 实验前两溶液的pH相等 | |
| B. | 实验前两溶液中离子种类完全相同 | |
| C. | 加入CaCl2溶液后生成的沉淀一样多 | |
| D. | 加入CaCl2溶液后反应的离子方程式都是CO32-+Ca2+═CaCO3↓ |
17.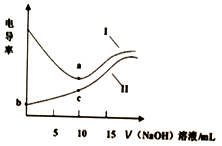 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )| A. | b点pH值大于1 | B. | 盐酸浓度为 0.lmol•L-1 | ||
| C. | c点:c(Na+)>c(A-)>c(H+)>c(OH-) | D. | 曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液 |
7.乙醇与酸性K2Cr2O7溶液混合可发生如下反应:Cr2O72-+C2H5OH+H+=Cr3++CH3COOH+H2O(未配平).下列叙述不正确的是( )
| A. | Cr2O72-中Cr元素化合价为+6 | |
| B. | 氧化产物为CH3COOH | |
| C. | K2Cr2O7溶液常用硫酸酸化 | |
| D. | lmol C2H5OH发生上述反应转移2mole- |
14.化学与人类生活、生产息息相关,下列说法错误的是( )
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰 | |
| B. | 地沟油可以用来制肥皂、提取甘油或者生产生物柴油 | |
| C. | 航天飞船中使用的碳纤维.是一种新型无机非金属材料 | |
| D. | 汽车排放的尾气和冬季取暖排放的顆粒污染物是形成雾霾的一个因素 |
11.下列说法中不正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1 | |
| B. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<① | |
| C. | 某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则 2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037 | |
| D. | 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)═c(H+)+c(HS-)+2c(H2S) |
4.下列除去杂质的方法不正确的是( )
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤 | |
| B. | SO2中混有少量SO3:通过足 量浓H2SO4,收集气体 | |
| C. | Cl2中混有少量HCl:通过碱石灰后收集气体 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2,过滤 |