题目内容
6.化学与社会、生活密切相关.对下列现象或事实及解释均正确的是( )| 选项 | 现象或事实 | 解释 |
| A | 化石燃料燃烧时采取脱硫措施 | 提高化石燃料的利用率 |
| B | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | 二者都有较强的吸水性 |
| C | 高温加热能杀死流感病毒 | 蛋白质受热变性 |
| D | 高铁车厢采用铝合金材料 | 铝和氧气不反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.化石燃料燃烧时能够产生大量的有毒气体二氧化硫;
B.铁粉不具有吸水性,具有还原性;
C.依据蛋白质的变性性质解答;
D.依据铝合金的性质解答.
解答 解:A.化石燃料燃烧时采取脱硫措施,能够减少二氧化硫的排放,有利于环境保护,故A错误;
B.铁粉不具有吸水性,具有还原性,可以防止食品氧化变质,故B错误;
C.高温能使蛋白质变性,所以高温加热能杀死流感病毒,故C正确;
D.车厢大部分采用铝合金材料制造,这是因为铝合金具有质量轻,强度大,抗腐蚀能力比较强的优点,故D错误;
故选:C.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确相关物质的性质是解题关键,注意对相关知识的积累,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.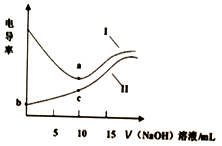 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )| A. | b点pH值大于1 | B. | 盐酸浓度为 0.lmol•L-1 | ||
| C. | c点:c(Na+)>c(A-)>c(H+)>c(OH-) | D. | 曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液 |
14.化学与人类生活、生产息息相关,下列说法错误的是( )
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰 | |
| B. | 地沟油可以用来制肥皂、提取甘油或者生产生物柴油 | |
| C. | 航天飞船中使用的碳纤维.是一种新型无机非金属材料 | |
| D. | 汽车排放的尾气和冬季取暖排放的顆粒污染物是形成雾霾的一个因素 |
11.下列说法中不正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1 | |
| B. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<① | |
| C. | 某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则 2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037 | |
| D. | 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)═c(H+)+c(HS-)+2c(H2S) |
18. 如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )
如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )
 如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )
如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )| A. | 使用催化剂 | B. | 升高温度 | C. | 增大压强 | D. | 提高 N2浓度 |
15.漂粉精久置空气中会变质,在变质过程中不会涉及的性质是( )
| A. | H2CO3的酸性 | B. | HClO 的不稳定性 | C. | HClO 的弱酸性 | D. | HClO 的漂白性 |
8.下列各离子组在溶液中不能大量共存的是( )
| A. | H+、NH4+、Cl-、SO42- | B. | NH4+、K+、NO3-、SO42- | ||
| C. | Mg2+、Ca2+、Cl-、HCO3- | D. | NO3-、Fe2+、H+、SO42- |
