题目内容
5.X、Y、Z三种元素的原子具有相同的电子层数,它们的最高价氧化物的水化物酸性由弱到强的顺序是H3XO4<H2YO4<HZO4,则下列说法正确的是( )| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由弱至强的顺序是X<Y<Z | |
| C. | 原子半径大小顺序是X<Y<Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
分析 X、Y、Z三种元素的原子具有相同电子层数,应为同一周期元素,它们的最高价氧化物对应水化物是H3XO4、H2YO4、HZO4,则X的最外层电子数为5,Y的最外层电子数为6,Z的最外层电子数为7,为非金属,原子序数X<Y<Z,根据同一周期元素的非金属性的递变规律以及元素的性质与对应单质、化合物的性质的关系解答该题.
解答 解:X、Y、Z三种元素的原子具有相同电子层数,应为同一周期元素,它们的最高价氧化物对应水化物是H3XO4、H2YO4、HZO4,则X的最外层电子数为5,Y的最外层电子数为6,Z的最外层电子数为7,为非金属,原子序数X<Y<Z,
A.根据分析可知,原子序数X<Y<Z,故A错误;
B.它们最高价氧化物的水化物的酸性强弱顺序是H3XO4<H2YO4<HZO4,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以非金属性:X<Y<Z,故B正确;
C.同周期,从左到右随原子序数的增大,原子半径减小,则原子半径为X>Y>Z,故C错误;
D.元素的非金属性越强,对应的氢化物的稳定性越强,非金属性:X<Y<Z,则气态氢化物稳定性:H3X<H2Y<HZ,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,明确同周期元素性质的变化规律及非金属性与最高价氧化物对应水化物的酸性的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
15.盐酸与块状CaCO3反应时,不能使反应的最初速率明显加快的是( )
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
16.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bm-、Cn-具有相同的电子层结构,且n>m,则下列关系正确的是( )
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |
13.实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
(2)配制时,其正确的操作顺序是B、C、A、F、E、D(用字母表示,每个字母只能用一次).
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶.
(4)若出现如下情况,对所配溶液浓度将有何影响?(填偏大、偏小、不变),没有进行A操作时浓度偏小;加蒸馏水时不慎超过了刻度线时浓度偏小;定容时俯视时浓度偏大.
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶.
(4)若出现如下情况,对所配溶液浓度将有何影响?(填偏大、偏小、不变),没有进行A操作时浓度偏小;加蒸馏水时不慎超过了刻度线时浓度偏小;定容时俯视时浓度偏大.
20.普通锌锰电池是我国最早进入市场的实用电池,筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2、碳黑等.在探究废干电池内的固体时,进行如图所示四步操作实验:
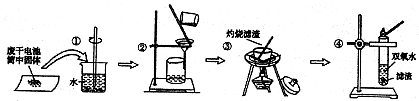
下列有关这些操作的叙述中,不正确的是( )

下列有关这些操作的叙述中,不正确的是( )
| A. | 操作①中玻璃棒的作用是加快固体溶解速度 | |
| B. | 取操作2的溶液于试管中,滴加适量氢氧化钠稀溶液,并用湿润的红色石蕊试纸放于试管口,发现试纸变蓝,可以证明有NH4Cl的存在 | |
| C. | 操作③中盛放药品的仪器是坩埚 | |
| D. | 操作④的目的是检验MnO2的存在 |
10.用滴管吸取和滴加少量试剂时,下列操作中不正确的是( )
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
17.下列数量的各物质所含原子总数按由大到小顺序排列的是( )
①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸(H3PO4)
①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸(H3PO4)
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①②④③ |
14.下列各组比较,不正确的是( )
| A. | 酸性:HI>HBr>HCl>HF | B. | 碱性:Be(OH)2<Mg(OH)2<KOH | ||
| C. | 氧化性:S<O2<F2 | D. | 还原性:O2-<S2-<I- |
5.可逆反应N2(g)+3H2(g)?2NH3(g)500℃时在容积为5L的密闭容器中进行,开始时加入1molN2和1molH2,则达到平衡时,NH3的浓度不可能达到的值是( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.15mol/L | D. | 0.05mol/L |