题目内容
5.可逆反应N2(g)+3H2(g)?2NH3(g)500℃时在容积为5L的密闭容器中进行,开始时加入1molN2和1molH2,则达到平衡时,NH3的浓度不可能达到的值是( )| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.15mol/L | D. | 0.05mol/L |
分析 先利用极值法,假如该反应不是可逆反应,计算出开始时加入1molN2和1molH2时生成氨气的最大量,然后根据c=$\frac{n}{V}$计算出氨气的浓度,最后根据该反应是可逆反应进行判断.
解答 解:N2(g)+3H2(g)?2NH3(g),依据极值法计算分析,若氮气和氢气全部反应则:1molN2和1molH2反应,根据化学方程式计算可知,1mol氮气完全反应消耗3mol氢气,氮气过量,氢气不足,若1mol氢气全部反应生成氨气物质的量为:1mol×$\frac{2}{3}$$\frac{2}{3}$mol,浓度为:$\frac{\frac{2}{3}mol}{5L}$≈0.133mol/L,
因为反应是可逆反应,不可能进行彻底,所以反应过程中生成的氨气浓度小于0.13mol/L,
选项中A、D有可能生成,而B、C不可能
故选BC.
点评 本题考查了化学反应的可逆性,题目难度不大,明确可逆反应特点为解答关键,注意掌握极值法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
5.X、Y、Z三种元素的原子具有相同的电子层数,它们的最高价氧化物的水化物酸性由弱到强的顺序是H3XO4<H2YO4<HZO4,则下列说法正确的是( )
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由弱至强的顺序是X<Y<Z | |
| C. | 原子半径大小顺序是X<Y<Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 28g乙烯中的电子总数为12NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 5.85g氯化钠晶体中含有Na+数为0.1NA | |
| D. | 氢气和氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
10.反应Br+H2?HBr+H的能量对反应历程的关系如图,则下列叙述中正确的是( )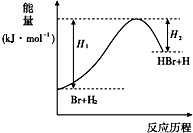

| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |
17.某些花岗岩会产生氡(22286Rn)对人体产生伤害,下列关于22286Rn的叙述中错误的是( )
| A. | 质子数是86 | B. | 电子数是86 | C. | 质量数是222 | D. | 中子数是222 |
14.下列金属适宜用电解法冶炼的是( )
| A. | 铁 | B. | 铝 | C. | 铜 | D. | 汞 |
 2Z;
2Z;