题目内容
17.下列数量的各物质所含原子总数按由大到小顺序排列的是( )①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸(H3PO4)
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①②④③ |
分析 先根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$分别计算出各物质的物质的量,然后结合各物质分子式组成计算出含有原子的物质的量;根据n=nNA可知,原子的物质的量越大,含有原子的数目越大,据此进行解答.
解答 解:①0.5mol氨气中含有原子的物质的量:0.5mol×4=2mol;
②标况下22.4L氦气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,稀有气体为单原子分子,1mol氦气含有1molHe原子;
③4℃时9mL水的质量为9g,物质的量为:$\frac{9g}{18g/mol}$=0.5mol,0.5mol水分子中含有原子的物质的量为:0.5mol×3=1.5mol;
④0.2mol磷酸(H3PO4)中含有原子的总物质的量为:0.2mol×8=1.6mol;
根据n=nNA可知,原子的物质的量越大,含有原子的数目越大,则含有原子总数按由大到小顺序排列为:①④③②,
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的转化关系为解答关键,②为易错点,注意稀有气体为单原子分子,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
7.下列各组物质中,互为同系物的是( )
| A. | 1H和2H | B. | O2和O3 | C. | CH4和CH2=CH2 | D. | C3H8和C4H10 |
5.X、Y、Z三种元素的原子具有相同的电子层数,它们的最高价氧化物的水化物酸性由弱到强的顺序是H3XO4<H2YO4<HZO4,则下列说法正确的是( )
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由弱至强的顺序是X<Y<Z | |
| C. | 原子半径大小顺序是X<Y<Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
12.下列有关放热反应、吸热反应的说法不正确的是( )
| A. | 放热反应放出热量的多少与反应物的质量和状态有关 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 28g乙烯中的电子总数为12NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 5.85g氯化钠晶体中含有Na+数为0.1NA | |
| D. | 氢气和氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
17.某些花岗岩会产生氡(22286Rn)对人体产生伤害,下列关于22286Rn的叙述中错误的是( )
| A. | 质子数是86 | B. | 电子数是86 | C. | 质量数是222 | D. | 中子数是222 |
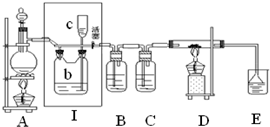 如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).