题目内容
11.下列说法不正确的是( )| A. | 碳酸钙与盐酸反应过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大 | |
| D. | 同一反应在同一时间内,用不同物质来表示的反应速率数值可能不同 |
分析 A.化学反应中,固体质量的多少不影响反应速率,但反应物的接触面积大小影响反应速率;
B.增大反应体系的压强,如果反应物、生成物浓度不变,则反应速率不变;
C.增大反应物浓度,增大单位体积内活化分子个数;
D.同一反应同一时间段内,各物质的反应速率之比等于其计量数之比.
解答 解:A.化学反应中,固体没有浓度而言,固体质量的多少不影响反应速率,但反应物的接触面积越大其反应速率越大,故A正确;
B.增大反应体系的压强,如果反应物、生成物浓度不变,则反应速率不变,所以增大反应体系的压强,反应速率不一定增大,故B正确;
C.增大反应物浓度,增大单位体积内活化分子个数,不是增大活化分子百分数,但其反应速率增大,故C错误;
D.同一反应同一时间段内,各物质的反应速率之比等于其计量数之比,各物质的计量数不一定一样,所以其反应速率不一定一样,故D正确;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、温度、压强对化学反应速率影响原理是解本题关键,易错选项是B.

练习册系列答案
相关题目
1.某同学用锌铜合金粉末与等体积、等浓度的稀硫酸分别做多次实验,现列出其中四组数据,请仔细阅读,回答有关问题:
(1)上表中空缺的数据应为7.25g;
(2)从上面的数据可以判断实验3(编号)是恰好完全反应.
(3)实验1中可选用硫酸锌的质量(物质名称)作为已知条件,计算放出氢气的体积是672mL(标准状况).
(4)锌铜合金中锌的质量分数为97.5%.
| 实验编号 | 锌铜合金质量/g | 硫酸/mL | 硫酸锌/g |
| 1 | 2.0 | 56 | 4.83 |
| 2 | 3.0 | 56 | |
| 3 | 4.0 | 56 | 9.66 |
| 4 | 5.0 | 56 | 9.66 |
(2)从上面的数据可以判断实验3(编号)是恰好完全反应.
(3)实验1中可选用硫酸锌的质量(物质名称)作为已知条件,计算放出氢气的体积是672mL(标准状况).
(4)锌铜合金中锌的质量分数为97.5%.
6.10g 10%的氢氧化钠溶液稀释成50mL,所得氢氧化钠溶液的物质的量浓度为( )
| A. | 0.02 mol/L | B. | 0.05 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
16.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )
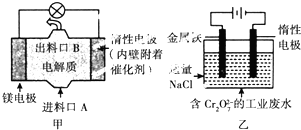

| A. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 | |
| C. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀 |
20.26g锌和含63gHNO3的稀硝酸正好完全反应,生成的还原产物的相对分子质量可能是( )
| A. | 80 | B. | 30 | C. | 46 | D. | 28 |
1.在298K、1.01×105Pa下,将22g CO2缓慢通入750mL 1mol•L-1NaOH溶液中充分反应后,测得反应放热为x kJ.已知该条件下,1mol CO2缓慢通入1L 2mol•L-1NaOH溶液中充分反应后放热为y kJ.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | 2CO2 (g)+2NaOH(aq)═2NaHCO3(aq)△H=-(8x-y) kJ•mol-1 |