题目内容
1.某同学用锌铜合金粉末与等体积、等浓度的稀硫酸分别做多次实验,现列出其中四组数据,请仔细阅读,回答有关问题:| 实验编号 | 锌铜合金质量/g | 硫酸/mL | 硫酸锌/g |
| 1 | 2.0 | 56 | 4.83 |
| 2 | 3.0 | 56 | |
| 3 | 4.0 | 56 | 9.66 |
| 4 | 5.0 | 56 | 9.66 |
(2)从上面的数据可以判断实验3(编号)是恰好完全反应.
(3)实验1中可选用硫酸锌的质量(物质名称)作为已知条件,计算放出氢气的体积是672mL(标准状况).
(4)锌铜合金中锌的质量分数为97.5%.
分析 根据实验1和实验3可知,加入4.0g合金时硫酸足量,则加入3.0g合金时生成硫酸锌的质量为:4.83g×$\frac{3.0g}{2.0g}$=7.25g;根据实验3、4可知,实验4中合金过量,再结合实验1、3可知,实验3中合金与硫酸恰好完全反应,据此结合表中数据进行计算.
解答 解:(1)实验3中加入4.0g合金时生成的硫酸锌质量为实验1中加入2.0g合金生成硫酸锌质量的2倍,则实验2中硫酸过量,合金完全反应,则生成硫酸锌的质量为:4.83g×$\frac{3.0g}{2.0g}$=7.25g,
故答案为:7.25g;
(2)根据实验3、4可知,实验4中合金过量,再结合实验1、3可知,实验3中合金与硫酸恰好完全反应,
故答案为:3;
(3)实验1中硫酸过量,生成了4.83g硫酸锌,则硫酸锌的物质的量为:$\frac{4.83g}{161g/mol}$=0.03mol,根据反应Zn+H2SO4═ZnSO4+H2↑可知,生成0.03mol硫酸锌时会放出0.03mol氢气,生成的氢气在标准状况下的体积为:22.4L/mol×0.03mol=0.672L=672mL,
故答案为:672;
(4)铜不与稀硫酸反应,则实验1中0.03mol氢气是锌与稀硫酸反应生成的,根据反应方程式Zn+H2SO4═ZnSO4+H2↑可知,2.0g合金中含有锌的物质的量为:0.03mol,质量为:65g/mol×0.03mol=1.95g,
所以合金中锌的质量分数为:$\frac{1.95g}{2.0g}$×100%=97.5%,
故答案为:97.5%.
点评 本题考查了混合物反应的计算,题目难度中等,根据表中数据正确判断过量情况为解答关键,注意掌握发生反应原理,试题培养了学生的分析能力及化学计算能力.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | C3H8 | B. | C4H10 | C. | C5H12 | D. | C6H14 |
| A. | H+、Ca2+、Cl-、CH3COO- | B. | NH4+、Ca2+、HCO3-、SO42- | ||
| C. | K+、Ba2+、OH-、Cl- | D. | Cu2+、H+、Cl-、SO42- |
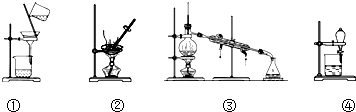
| A. | 除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 | |
| B. | 用②装置除去自来水中的Cl-等杂质 | |
| C. | 回收碘的CCl4溶液中的CCl4,可选用③装置 | |
| D. | 分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
| A. | 在常温、常压下11.2L N2含有的分子数为0.5NA | |
| B. | 标况下,22.4LH2的分子数为NA | |
| C. | 标况下,18g水的体积是22.4L | |
| D. | 1molSO2的体积是22.4L |
| A. | NaCl→NaNO3 | B. | MnO4-→Mn2+ | C. | Zn→ZnSO4 | D. | CuO→CuSO4 |
| 序号 | 检 验 方 法 | 结 论 |
| A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有Cl- |
| B | 向一种未知溶液中滴加盐酸,有气泡产生 | 未知溶液中一定含有CO${\;}_{3}^{2-}$ |
| C | 将一种未知气体通入品红溶液,溶液褪色,加热后又恢复红色 | 未知气体是SO2 |
| D | 向一种未知溶液中滴加BaCl2溶液,有白色沉淀 | 未知溶液中一定含有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 碳酸钙与盐酸反应过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大 | |
| D. | 同一反应在同一时间内,用不同物质来表示的反应速率数值可能不同 |