题目内容
6.10g 10%的氢氧化钠溶液稀释成50mL,所得氢氧化钠溶液的物质的量浓度为( )| A. | 0.02 mol/L | B. | 0.05 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
分析 先计算出溶液中含有氢氧化钠的质量,再根据n=$\frac{m}{M}$计算出氢氧化钠的物质的量,最后根据c=$\frac{n}{V}$计算出所得氢氧化钠溶液的物质的量浓度.
解答 解:10g 10%的氢氧化钠溶液中含有氢氧化钠的质量为:10g×10%=1g,
1g氢氧化钠的物质的量为:n(NaOH)=$\frac{1g}{40g/mol}$=0.025mol,
稀释后溶液中氢氧化钠的浓度为:c(NaOH)=$\frac{0.025mol}{0.05L}$=0.5mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与物质的量浓度、摩尔质量之间的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.如图所示的四种实验操作对应描述正确的是( )
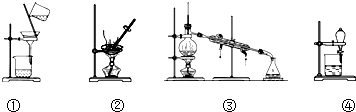

| A. | 除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 | |
| B. | 用②装置除去自来水中的Cl-等杂质 | |
| C. | 回收碘的CCl4溶液中的CCl4,可选用③装置 | |
| D. | 分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
17.同温同压下,下列气体的密度最大的是( )
| A. | 氢气 | B. | 二氧化硫 | C. | 氧气 | D. | 二氧化碳 |
14.一定温度下,可逆反应2NO2?2NO+O2在体积固定的密闭容器中反应,达到平衡状态标志的是( )
①单位时间内生成n mol O2,同时消耗2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均摩尔质量不再改变.
①单位时间内生成n mol O2,同时消耗2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均摩尔质量不再改变.
| A. | ①③⑤⑥ | B. | ①②③⑤ | C. | ②③④⑥ | D. | ④⑤⑥ |
11.下列说法不正确的是( )
| A. | 碳酸钙与盐酸反应过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大 | |
| D. | 同一反应在同一时间内,用不同物质来表示的反应速率数值可能不同 |
18.氢氧化铁胶体区别于FeCl3溶液最本质的特征( )
| A. | Fe(OH)3胶体粒子的直径在1~100 nm之间 | |
| B. | Fe(OH)3胶体具有丁达尔效应 | |
| C. | Fe(OH)3胶体是均一的分散系 | |
| D. | Fe(OH)3胶体的分散质能通过滤纸 |
16.下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是:( )
①Al ②Fe3O4③NaHCO3 ④Al(OH)3⑤Na2CO3.
①Al ②Fe3O4③NaHCO3 ④Al(OH)3⑤Na2CO3.
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |