题目内容
1.(Ⅰ)已知某有机物A的分子式是C2H4,能发生下列转化关系(部分反应)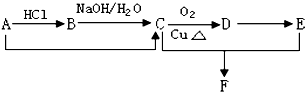
请回答下列问题:
(1)写出下列物质的结构简式:BCH3CH2Cl,DCH3CHO;
(2)写出下列反应类型:A→B加成反应,C+E→F酯化反应或取代反应;
(3)写出下列反应的化学方程式:C+E→FCH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(Ⅱ)近年来,乳酸CH3CH(OH)COOH成为人们的研究热点之一.乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备.乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水.请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是a氢氧化钠或碳酸钠,b钠;
CH3CH(OH)COOH $\stackrel{a}{→}$CH3CH(OH)COONa$\stackrel{b}{→}$CH3CH(ONa)COONa
(2)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1mol该物质能跟金属钠反应产生1molH2.它的结构简式为HOCH2CH(OH)CHO.(已知同一个碳原子上不能连接2个羟基)
分析 (I)有机物A的分子式是C2H4,则A为CH2=CH2,乙烯与HCl发生加成反应生成B为CH3CH2Cl,氯乙烷水解生成C为CH3CH2OH,乙醇催化氧化生成D为CH3CHO,乙醛进一步氧化生成E为CH3COOH,乙醇与乙酸发生酯化反应生成F为CH3COOCH2CH3;
(II)(1)乳酸与氢氧化钠或碳酸钠等反应生成CH3CH(OH)COONa,再与钠反应生成CH3CH(Na)COONa;
(2)乳酸的同分异构体满足:可以发生银镜反应,说明含有醛基,1mol该物质能跟金属钠反应产生1molH2,说明还含有2个羟基.
解答 解:(I)有机物A的分子式是C2H4,则A为CH2=CH2,乙烯与HCl发生加成反应生成B为CH3CH2Cl,氯乙烷水解生成C为CH3CH2OH,乙醇催化氧化生成D为CH3CHO,乙醛进一步氧化生成E为CH3COOH,乙醇与乙酸发生酯化反应生成F为CH3COOCH2CH3.
(1)由上述分析可知,B的结构简式为CH3CH2Cl,D的结构简式为:CH3CHO,
故答案为:CH3CH2Cl;CH3CHO;
(2)A→B属于加成反应,C+E→F属于酯化反应或取代反应,
故答案为:加成反应;酯化反应或取代反应;
(3)C+E→F的反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(II)(1)乳酸与氢氧化钠或碳酸钠等反应生成CH3CH(OH)COONa,再与钠反应生成CH3CH(Na)COONa,
故答案为:氢氧化钠或碳酸钠;钠;
(2)乳酸的同分异构体满足:可以发生银镜反应,说明含有醛基,1mol该物质能跟金属钠反应产生1molH2,说明还含有2个羟基,符合条件的同分异构体为:HOCH2CH(OH)CHO,
故答案为:HOCH2CH(OH)CHO.
点评 本题考查有机物推断、有机物结构与性质、限制条件同分异构体书写等,涉及烯烃、醇、醛、羧酸、酯的性质等,有利于基础知识的巩固.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案(1)已知常温下KMnO4溶液的pH=7,则0.01mol/LHMnO4溶液的pH=2;研究表明,一定温度下将酸性KMnO4溶液与草酸溶液混合在一起后,溶液内n(Mn2+)随时间变化的情况如图1,则Mn2+物质的量在t1、t2时段内快速增加的原因可能是反应生成的Mn2+对反应起催化作用.
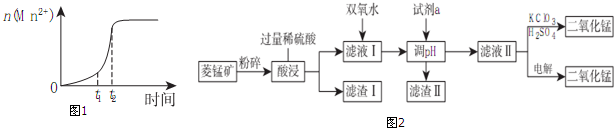
(2)工业上以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰有多种方法,图2是其中的一种生产流程示意图
常温下几种金属氢氧化物沉淀时的pH:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
为确保除尽杂质而又不损失锰,pH的调整范围为6.7≤pH<8.3.
②滤液Ⅱ中加入KClO3、H2SO4后反应的化学方程式为3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,用电解法制备MnO2时阳极上的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(3)锰也是制备某些高能原电池的材料,某二次水溶液锂离子电池充电时,总反应方程式为LiMn2O═4Li1-xMn2O4+xLi.若电池的化学能转化为电能时的能量转化率为85%,则当消耗14g锂时,电路中转移的电子数目为1.7 NA.
| A. | 制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 | |
| B. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁 |
| A. | PCl3 | B. | CH4 | C. | BF3 | D. | H2O |
 的是( )
的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
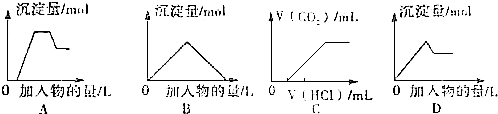
| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.