题目内容
1.下列反应能设计成原电池的是( )| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
分析 能设计成原电池的反应必须是自发进行的放热的氧化还原反应,据此分析解答.
解答 解:A.该反应不是氧化还原反应,所以不能设计成原电池,故A错误;
B.该反应不是氧化还原反应,所以不能设计成原电池,故B错误;
C.该反应不是氧化还原反应,所以不能设计成原电池,故C错误;
D.CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故D正确;
故选D.
点评 本题考查了原电池原理,明确原电池反应类型是解本题关键,自发的氧化还原反应能设计为原电池,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列不能说明Cl的得电子能力比S强的亊实是( )
①HCl比H2S稳定
②HCl0氧化性比KH2S04强
③HClO4酸性比H2SO4强
④Cl2能与H2S 反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成 FeCl3,S与Fe反应生成FeS.
①HCl比H2S稳定
②HCl0氧化性比KH2S04强
③HClO4酸性比H2SO4强
④Cl2能与H2S 反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成 FeCl3,S与Fe反应生成FeS.
| A. | ②⑤ | B. | ①② | C. | ①②④ | D. | ①③⑤ |
16.下列表示物质或微粒的化学用语正确的是( )
| A. | HF的电子式为 | B. | Mg2+的结构示意图为 | ||
| C. | CO2的电子式为: | D. | Cl-的结构示意图为 |
10.下列说法正确的是( )
| A. | 35Cl和37Cl的原子结构示意图相同 | |
| B. | 元素H只有11H和21H两种核素 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 1mol HCl分子和1mol HF分子断键需要的能量前者大于后者 |
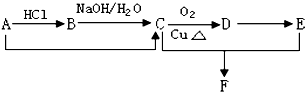
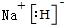 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.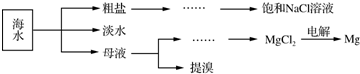
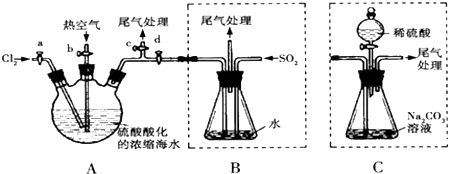
 .
.