题目内容
6. 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.根据乙醇的结构(如图),写出无水乙醇和浓硫酸混合加热的化学方程式:
(1)170℃时:②,⑤键断裂,属于消去反应.
(2)140℃时:①,②键断裂,属于取代反应.
乙醇的上述化学性质说明,决定乙醇主要化学性质的基团是醇羟基.
分析 (1)170℃时:乙醇中C-O键和连接醇羟基的碳原子相邻碳原子上的H原子脱去而发生消去反应;
(2)140℃时,一个乙醇分子中醇羟基上的O-H键断裂、另一个乙醇分子中C-O键断裂而发生取代反应;
官能团决定物质性质,乙醇的性质取决于乙醇的官能团.
解答 解:(1)170℃时:乙醇中C-O键和连接醇羟基的碳原子相邻碳原子上的H原子脱去而发生消去反应,即②⑤键断裂,反应类型是消去反应;
故答案为:②;⑤;消去;
(2)140℃时,一个乙醇分子中醇羟基上的O-H键断裂、另一个乙醇分子中C-O键断裂而发生取代反应,即①②断裂,反应类型是取代;
官能团决定物质性质,乙醇的性质取决于乙醇的官能团,乙醇的官能团是醇羟基,则决定乙醇主要化学性质的基团是醇羟基,
故答案为:①;②;取代;醇羟基.
点评 本题考查有机物结构和性质,为高频考点,官能团决定性质,侧重考查学生对反应类型的理解和掌握,注意其断键和成键方式,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
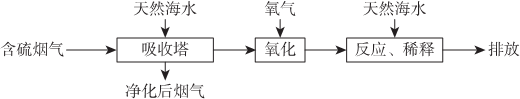
下列说法错误的是( )

下列说法错误的是( )
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
17.下列有机物中属于醇的是( )
| A. |  | B. |  | C. |  | D. | CH3-O-CH3 |
14.下列关于卤族元素的说法正确的是( )
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易 |
11.化学与工农业生产和人类生活密切相关,下列说法正确的是( )
| A. | 向汽油中添加乙醇后,该混合燃料的热值不变,但可以达到减排的目的 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 光导纤维、氧化铝陶瓷、PE、硅藻土都是无机非金属材料,橡胶、酚醛树脂都是人工合成高分子材料 | |
| D. | 泡沫灭火器是常见灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液,外筒为金属材质,内外筒之间盛装硫酸铝溶液 |
18.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
5.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而与稀硫酸几乎不反应.这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致.为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象.
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显.
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.
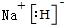 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.