题目内容
9.下列分子中中心原子采取sp2杂化的是( )| A. | PCl3 | B. | CH4 | C. | BF3 | D. | H2O |
分析 根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型.
解答 解:A.NH3中N形成3个δ键,孤电子对数=$\frac{5-3×1}{2}$=1,为sp3杂化,故A错误;
B.CH4中C形成4个δ键,无孤电子对,为sp3杂化,故B错误;
C.BF3中B形成3个δ键,无孤电子对,为sp2杂化,故C正确;
D.H2O中O形成2个δ键,孤电子对数=$\frac{6-2×1}{2}$=2,为sp3杂化,故D错误;
故选:C.
点评 本题考查了原子杂化类型的判断,难度不大,根据杂化轨道数=δ键数+孤对电子对数来解答即可,原子杂化类型的判断是高考的热点.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
20.据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程如图:下列说法中不正确的是( )
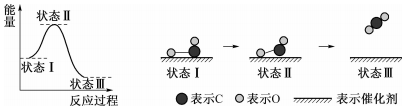

| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO没有断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
17.下列有机物中属于醇的是( )
| A. |  | B. |  | C. |  | D. | CH3-O-CH3 |
4.下列有关化学用语表示正确的是( )
| A. | 熔融状态下硫酸氢钾的电离方程式:KHSO4═K++H++SO42- | |
| B. | Cl-的结构示意图: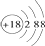 | |
| C. | 中子数为8的碳原子:${\;}_{6}^{14}$C | |
| D. | NaCl的电子式: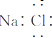 |
14.下列关于卤族元素的说法正确的是( )
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易 |
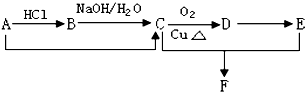
18.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |