题目内容
短周期元素A、B、C、D在周期表中的相对位置如表所示:
已知B元素原子的外围电子排布为nsnnp(n+1),回答下列问题:
(1)含A的化合物甲醇(CH3-OH)的沸点比甲醛HCHO高,其原因是 ;
(2)单质B的结构式是 ;
(3)表中,最高价氧化物的水化物碱性最强的碱是 (填化学式),B最高价氧化物的水化物与其氢化物形成的物质中,存在的相互作用是 (多选,填序号)
A.金属键 B.离子键 C.极性键 D.非极性键 E.配位键 F.范德华力 G.氢键
(4)D原子外围电子的轨道表示式 .
| A | B | ||
| C | D |
(1)含A的化合物甲醇(CH3-OH)的沸点比甲醛HCHO高,其原因是
(2)单质B的结构式是
(3)表中,最高价氧化物的水化物碱性最强的碱是
A.金属键 B.离子键 C.极性键 D.非极性键 E.配位键 F.范德华力 G.氢键
(4)D原子外围电子的轨道表示式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D属于短周期元素,根据元素在周期表中的位置知,A和B属于第二周期元素,C和D属于第三周期元素,B元素原子的外围电子排布为nsnnp(n+1),n=2,所以B元素原子的外围电子排布为2s22p3,所以B是N元素,则A是C元素、C是Mg元素、D是P元素,
(1)氢键的存在导致物质的沸点升高;
(2)氮气分子中氮原子之间存在共价三键;
(3)元素的金属性越强,则其最高价氧化物的水化物碱性越强;B的最高价氧化物的水化物是硝酸,氢化物是氨气,硝酸和氨气反应生成硝酸铵,阴阳离子之间存在离子键、不同非金属元素之间存在极性键、含有空轨道的原子和含有孤电子对的原子之间存在配位键;
(4)D是P元素,P原子最外层电子是其外围电子,其最外层上有2个3s电子、3个3p电子.
(1)氢键的存在导致物质的沸点升高;
(2)氮气分子中氮原子之间存在共价三键;
(3)元素的金属性越强,则其最高价氧化物的水化物碱性越强;B的最高价氧化物的水化物是硝酸,氢化物是氨气,硝酸和氨气反应生成硝酸铵,阴阳离子之间存在离子键、不同非金属元素之间存在极性键、含有空轨道的原子和含有孤电子对的原子之间存在配位键;
(4)D是P元素,P原子最外层电子是其外围电子,其最外层上有2个3s电子、3个3p电子.
解答:
解:A、B、C、D属于短周期元素,根据元素在周期表中的位置知,A和B属于第二周期元素,C和D属于第三周期元素,B元素原子的外围电子排布为nsnnp(n+1),n=2,所以B元素原子的外围电子排布为2s22p3,所以B是N元素,则A是C元素、C是Mg元素、D是P元素,
(1)甲醇中含有氢键,甲醛中没有氢键,氢键的存在导致物质的沸点升高,所以甲醇的沸点高于甲醛,故答案为:甲醇中含有氢键、甲醛中不含氢键;
(2)氮气分子中氮原子之间存在共价三键,其结构式为N≡N,故答案为:N≡N;
(3)元素的金属性越强,则其最高价氧化物的水化物碱性越强,镁的金属性最强,所以Mg(OH)2的碱性最强;B的最高价氧化物的水化物是硝酸,氢化物是氨气,硝酸和氨气反应生成硝酸铵,铵根离子和硝酸根离子之间存在离子键、氮原子和氢原子之间有一个配位键三个极性键、氮原子和氧原子之间存在极性键,故选BCE;
故答案为:Mg(OH)2;BCE;
(4)D是P元素,P原子最外层电子是其外围电子,其最外层上有2个3s电子、3个3p电子,其外围电子轨道表示式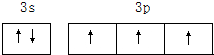 ,
,
故答案为 .
.
(1)甲醇中含有氢键,甲醛中没有氢键,氢键的存在导致物质的沸点升高,所以甲醇的沸点高于甲醛,故答案为:甲醇中含有氢键、甲醛中不含氢键;
(2)氮气分子中氮原子之间存在共价三键,其结构式为N≡N,故答案为:N≡N;
(3)元素的金属性越强,则其最高价氧化物的水化物碱性越强,镁的金属性最强,所以Mg(OH)2的碱性最强;B的最高价氧化物的水化物是硝酸,氢化物是氨气,硝酸和氨气反应生成硝酸铵,铵根离子和硝酸根离子之间存在离子键、氮原子和氢原子之间有一个配位键三个极性键、氮原子和氧原子之间存在极性键,故选BCE;
故答案为:Mg(OH)2;BCE;
(4)D是P元素,P原子最外层电子是其外围电子,其最外层上有2个3s电子、3个3p电子,其外围电子轨道表示式
 ,
,故答案为
 .
.
点评:本题考查了元素周期表和元素周期律,根据元素在周期表中的位置确定元素,结合原子结构、元素周期律来分析解答,注意铵根离子中不仅含有极性键还含有配位键,配位键也属于共价键.

练习册系列答案
相关题目
敞口放置下列物质,不会造成大气污染的是( )
| A、浓盐酸 | B、碘盐 | C、苯 | D、浓硝酸 |
普通锌锰干电池的外壳是锌筒,内置一个碳棒作电极,工作时发生的反应为:
2Zn+4NH4Cl+4MnO2═Zn(NH3)4Cl2+ZnCl2+2Mn2O3+2H2O
下列有关说法不正确的是( )
2Zn+4NH4Cl+4MnO2═Zn(NH3)4Cl2+ZnCl2+2Mn2O3+2H2O
下列有关说法不正确的是( )
| A、干电池的负极是锌筒 |
| B、MnO2在碳棒上发生还原反应 |
| C、闲置时间过长干电池也会失去供电能力 |
| D、工作时电解液中的NH4+移向负极 |
下列表示对应化学反应的离子方程式正确的是( )
| A、向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O | ||
| B、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O | ||
| C、向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | ||
D、向新制Cu(OH)2中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-
|
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、2g氢气所含原子数是NA |
| B、17g NH3所含的电子数是10NA |
| C、NA个氧分子和NA个氢分子的质量比等于1:1 |
| D、2.3g金属钠全部变成钠离子时失去的电子数是0.2NA |
