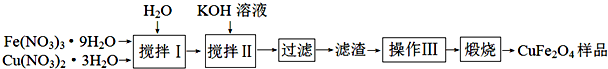
题目内容
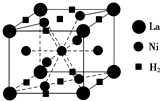
7.有下列离子晶体立体结构示意图: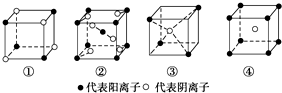
若以M代表阳离子,以R代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )
| A. | ①MR ②MR2 ③MR3 ④MR4 | B. | ①MR ②MR2 ③MR2 ④MR | ||
| C. | ①MR2 ②MR2 ③MR2 ④MR | D. | ①MR ②MR ③MR2 ④MR2 |
分析 ①中阴阳离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,阴阳离子个数之比为1:1;
②中M离子个数=1+8×$\frac{1}{8}$=2,R离子个数=2+4×$\frac{1}{2}$=4;
③中M离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,R离子个数为1;
④中M离子个数=8×$\frac{1}{8}$=1,R离子个数1;
阴阳离子个数之比等于其化学式中离子个数之比,据此判断化学式.
解答 解:①中阴阳离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,阴阳离子个数之比为$\frac{1}{2}$:$\frac{1}{2}$=1:1,其化学式为MR;
②中M离子个数=1+8×$\frac{1}{8}$=2,R离子个数=2+4×$\frac{1}{2}$=4,阴阳离子个数之比=4:2=2:1,所以其化学式为MR2;
③中M离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,R离子个数为1,阴阳离子个数之比=1:$\frac{1}{2}$=2:1,所以其化学式为MR2;
④中M离子个数=8×$\frac{1}{8}$=1,R离子个数1,阴阳离子个数之比=1:1,所以其化学式为MR;
故选B.
点评 本题考查晶胞计算,侧重考查分析计算能力,正确判断离子被几个晶胞占有是解本题关键,题目难度不大.

练习册系列答案
相关题目
17.(1)CO2经过催化氢化可合成低碳烯烃.
其合成乙烯的反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);△H. 几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
则△H=-128kJ/mol
(2)以稀硫酸为电解质溶液,利用太阳能也可将CO2转化为低碳烯烃,工作原理图如图1.

①b电极的名称是正极.②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
(3)工业上采用CO2与乙苯脱氢生产重要化工原料苯乙烯,反应如下:
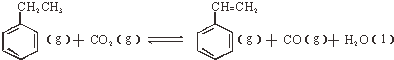 ;△H<0
;△H<0
①下列叙述能说明乙苯与CO2反应已达到平衡状态的是ad.
a.恒温恒压时气体密度不变b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成 1mol H2O
d.CO2的体积分数保持不变
②在2L密闭容器内,CO2与乙苯发生反应.在三种不同的条件下进行实验,CO2、乙苯的起始浓度均分别为3mol/L和1mol/L,其中实验I在T1°C、P1 Pa下,而实验Ⅱ、Ⅲ分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图2所示.则:实验ⅠCO2在0-50min时的反应速率为0.012mol/(L•min).
实验Ⅲ可能改变的条件是升高温度.
③实验Ⅰ达到平衡后,在该温度下,向该容器中再通入CO2和乙苯各1mol,重新达到平衡时,乙苯的转化率将减少(填“增大”、“减小”或“不变”),此时平衡常数为0.375.
其合成乙烯的反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);△H. 几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
| 物质 | H2(g) | CO2(g) | CH2=CH2 | H2O(g) |
| 能量:KJ/mol | 0 | -394 | 52 | -242 |
(2)以稀硫酸为电解质溶液,利用太阳能也可将CO2转化为低碳烯烃,工作原理图如图1.

①b电极的名称是正极.②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
(3)工业上采用CO2与乙苯脱氢生产重要化工原料苯乙烯,反应如下:
 ;△H<0
;△H<0①下列叙述能说明乙苯与CO2反应已达到平衡状态的是ad.
a.恒温恒压时气体密度不变b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成 1mol H2O
d.CO2的体积分数保持不变
②在2L密闭容器内,CO2与乙苯发生反应.在三种不同的条件下进行实验,CO2、乙苯的起始浓度均分别为3mol/L和1mol/L,其中实验I在T1°C、P1 Pa下,而实验Ⅱ、Ⅲ分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图2所示.则:实验ⅠCO2在0-50min时的反应速率为0.012mol/(L•min).
实验Ⅲ可能改变的条件是升高温度.
③实验Ⅰ达到平衡后,在该温度下,向该容器中再通入CO2和乙苯各1mol,重新达到平衡时,乙苯的转化率将减少(填“增大”、“减小”或“不变”),此时平衡常数为0.375.
18.化学与生活密切相关.下列说法正确的是( )
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |
2.下列关于乙烯(CH2=CH2)的说法不正确的( )
| A. | 乙烯分子中2个碳原子都是sp2杂化 | B. | 乙烯分子存在非极性键 | ||
| C. | 乙烯分子中4个H原子在同一平面上 | D. | 乙烯分子有6个σ键 |
16.常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图.下列分析正确的是( )
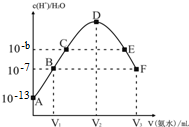

| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.
 、
、 ;
; .
.