题目内容
2.下列关于乙烯(CH2=CH2)的说法不正确的( )| A. | 乙烯分子中2个碳原子都是sp2杂化 | B. | 乙烯分子存在非极性键 | ||
| C. | 乙烯分子中4个H原子在同一平面上 | D. | 乙烯分子有6个σ键 |
分析 A.根据价层电子对互斥理论确定杂化方式;
B.同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键;
C.乙烯分子的空间结构为平面方形;
D.共价单键是σ 键,共价双键中一个是σ 键一个是π键.
解答 解:A.乙烯分子中2个碳原子的价层电子对数为3,所以碳碳双键两端的碳原子采用sp2杂化,故A正确;
B.同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,所以分子存在非极性键,故B正确;
C.乙烯分子的空间结构为平面方形,所以4个H原子在同一平面上,故C正确;
D.共价单键是σ 键,共价双键中一个是σ 键一个是π键,所以乙烯中有5个σ 键,1个π 键,故D错误;
故选D.
点评 本题考查了原子的杂化方式、分子的空间构型、极性键和非极性键的判断等知识点,利用知识迁移的方法进行分析解答,难度不大.

练习册系列答案
相关题目
12.我国古代人民编写的古诗或谚语包含了丰富的化学知识,下列解释正确的是( )
| 选项 | 古诗或谚语 | 含有的化学反应类型 |
| A | 爆竹声中除旧岁,春风送暖入屠苏 | 复分解反应 |
| B | 千锤万凿出深山,烈火焚烧若等闲 | 分解反应 |
| C | 春蚕到死丝方尽,蜡炬成灰泪始干 | 化合反应 |
| D | 真金不怕火,怕火便是铜 | 置换分解反应 |
| A. | A | B. | B | C. | C | D. | D |
13.在由水电离出的c(OH-)=1×10-13 mol/L的溶液中,可能大量共存的离子组是( )
| A. | Fe2+ Na+ NO3- Cl- | B. | Ba2+ Cu2+ NO${\;}_{3}^{-}$ Cl- | ||
| C. | SO42- SO3- NH4+ Na+ | D. | Mg2+ Na+ Br- ClO- |
10.解释下列物质性质的变化规律时,与共价键的键能无关的是( )
| A. | N2比O2的化学性质稳定 | B. | F2、Cl2、Br2、I2的沸点逐渐升高 | ||
| C. | 金刚石的熔点比晶体硅高 | D. | HF、HCl、HBr、HI的热稳定性依减弱 |
7.有下列离子晶体立体结构示意图:
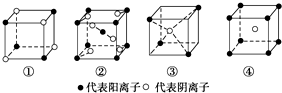
若以M代表阳离子,以R代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )

若以M代表阳离子,以R代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )
| A. | ①MR ②MR2 ③MR3 ④MR4 | B. | ①MR ②MR2 ③MR2 ④MR | ||
| C. | ①MR2 ②MR2 ③MR2 ④MR | D. | ①MR ②MR ③MR2 ④MR2 |
14.下列物质分类错误的是( )
| A. | 同系物:乙酸、软脂酸、硬脂酸 | B. | 同位素:氕、氘、氚 | ||
| C. | 同素异形体:金刚石、石墨、足球烯 | D. | 同分异构体:蔗糖、麦芽糖、葡萄糖 |
11.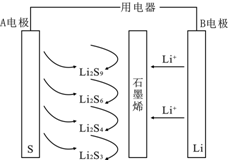 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | A电极上发生的一个电极反应为:2Li++6S+2e-=Li2S6 | |
| C. | 若对该电池充电,B电极接电源正极 | |
| D. | B电极发生还原反应 |
16.下列不属于同种物质的是( )
| A. |  和 和 | B. |  和 和 | ||
| C. |  和CH2═CH-CH2Cl 和CH2═CH-CH2Cl | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |