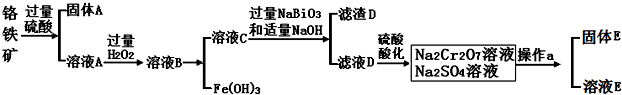
��Ŀ����
13��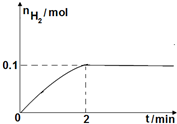 ��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ����SO2+2H2O+I2�TH2SO4+2HI
��2HI�TH2+I2
��2H2SO4�T2SO2��+O2��+2H2O
��1������������Ӧ�������ж���ȷ����c��
a����Ӧ�����ڳ����½��� b����Ӧ����SO2�����Ա�HIǿ
c��ѭ���������貹��H2Od��ѭ�������в���1mol O2��ͬʱ����1mol H2
��2��һ���¶��£���1L�ܱ������м���1mol HI��g����������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
0��2min�ڵ�ƽ����Ӧ����v��HI��=0.1 mol•L-1•min-1��
��3��ʵ������Zn��ϡ������ȡH2�����������������Լ��е�b������H2�����ʽ���������ĸ����
a��NaNO3b��CuSO4 c��Na2SO4 d��NaHSO3
��4����H2Ϊȼ�Ͽ��Ƴ�����ȼ�ϵ�أ�
��֪2H2��g��+O2��g���T2H2O��l����H=-572KJ•mol-1
ij����ȼ�ϵ���ͷ�228.8KJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ80%��
��5�����������ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g���TCH3OH��g������H=-90.8kJ•mol-1
��2CH3OH��g���TCH3OCH3��g��+H2O��g������H=-23.5kJ•mol-1
��CO��g��+H2O��g���TCO2��g��+H2��g������H=-41.3kJ•mol-1
�ܷ�Ӧ��3H2��g��+3CO��g���TCH3OCH3��g��+CO2 ��g���ġ�H=-246.4kJ•mol-1��
��6���жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־��cd������ĸ����
a��v���ɣ�CH3OH��=v���ģ�CO�� b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı� d��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯
��7����ij�¶��£���һ���ݻ�������ܱ�������ͨ��2.5mol CO��7.5mol H2��Ӧ����CH3OH��g�����ﵽƽ��ʱCO��ת����Ϊ90%����ʱ�����ڵ�ѹǿΪ��ʼʱ��0.55����
���� ��1��������֪�ķ�Ӧ���������ʵ����ʣ�������������ԭ��Ӧ�����������Ե�ǿ��������������֪��Ӧ�ɵõ��ֽ�ˮ�������ķ�Ӧ�����
a���������ڳ������ȶ������²�������
b���ɷ�Ӧ���֪����ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�
c���ɷ�Ӧ���2+���2+��ɵõ�2H2O�T2H2+O2�����ѭ��������ˮ��
d����ѧ����ʽ������ϵ�����֪��ѭ�������в���1molO2��ͬʱ����2molH2��
��2����ͼ��֪��2min��H2���ʵ����ı仯����Ȼ����㻯ѧ��Ӧ���ʣ������û�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮��������⻯��ķ�Ӧ���ʣ�
��3������ԭ���ԭ����������Ӧ���ʼӿ��ԭ��
a��������NaNO3��Һ�γɵ�ϡ������������ǿ�����Ժ�п��Ӧ��������������
b������CuSO4 ��Zn������ͭ��Һ��Ӧ�û���Cu������Һ���γ�ԭ��ط�Ӧ��
c��Na2SO4 �ļ��룬���Ӳ����뷴Ӧ����Ի�ѧ��Ӧ������Ӱ�죻
d������NaHSO3���H+��Ӧ������c��H+����
��4�������Ȼ�ѧ��Ӧ����ʽ��������1molˮ�ų���������������ȼ�ϵ���ͷ�228.8KJ�����������ص�����ת���ʣ�
��5���ݸ�˹��������֪���Ȼ�ѧ����ʽ������Ӧ����ֵ���мӼ���������Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ����ֵ���мӼ����ɸ�˹���ɿ�֪���١�2+��+�۵õ���
��6�����ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��7�����ݻ�ѧ��Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�ȣ���ϻ�ѧ��Ӧ���м��㷽����ʽ���㣮
��� �⣺��1��a���������ڳ������ȶ�����Ӧ�����²���������a����
b���ɷ�Ӧ���֪����ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ���ԭ��SO2��HI����SO2�������Ա�HI��������b����
c���ɷ�Ӧ���2+���2+��ɵõ�2H2O�T2H2+O2�����ѭ��������ˮ����Ҫ��ʱ����ˮ����c��ȷ��
d����2SO2+4H2O+2I2�T2H2SO4+4HI
��4HI�T2H2+2I2
��2H2SO4�T2SO2��+O2��+2H2O
ѭ�������в���1molO2��ͬʱ����2molH2����d����
�ʴ�Ϊ��c��
��2����ͼ��֪2min�����������ʵ���������0.1mol����������Ũ��Ϊ$\frac{0.1mol}{1L}$=0.1mol/L����������ʾ�Ļ�ѧ��Ӧ����Ϊ$\frac{0.1mol/L}{2min}$=0.05mol/��L��min������Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�0��2min�ڵ�ƽ����Ӧ����v��HI��=2V��H2��=2��0.05mol/��L��min��=0.1mol/��L��min����
�ʴ�Ϊ��0.1mol/��L��min����
��3��a��������NaNO3��Һ�γɵ�ϡ������������ǿ�����ԣ���������������a����
b������CuSO4 ��Zn������ͭ��Һ��Ӧ�û���Cu������Һ���γ�ԭ��ط�Ӧ����ԭ��ؼӿ��˻�ѧ��Ӧ���ʣ���b��ȷ��
c��Na2SO4 �ļ��룬���Ӳ����뷴Ӧ����Ի�ѧ��Ӧ������Ӱ�죬��c����
d������NaHSO3���H+��Ӧ������c��H+������Ӧ���ʼ�������d����
�ʴ�Ϊ��b��
��4����2H2��g��+O2��g���T2H2O��I����H=-572KJ��mol-1��֪������1molˮʱ�ų�������Ϊ572KJ��$\frac{1}{2}$=286KJ��
���ص�����ת����ΪΪ$\frac{228.8KJ}{286KJ}$��100%=80%���ʴ�Ϊ��80%��
��5����֪����CO��g��+2H2��g��?CH3OH��g����H=-90.8kJ/mol��
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=-23.5kJ/mol��
��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.3kJ/mol��
�ɸ�˹���ɿ�֪���١�2+��+�۵�3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g����H=-246.4kJ/mol��
�ʴ�Ϊ��-246.4kJ/mol��
��6��2H2��g��+CO��g���TCH3OH��g����H=-90.8kJ/mol����Ӧ�����������С�ķ��ȷ�Ӧ��
a����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮��Ϊ����Ӧ��������֮�ȣ�v���ɣ�CH3OH��=v���ģ�CO����Ӧ������Ӧ����֮�ȣ�ֻ��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����a����
b����Ӧǰ�������������䣬������䣬���������ܶ�ʼ�ղ��ı䣬����˵����Ӧ�ﵽƽ��״̬����b����
c����Ӧǰ���������ʵ����仯�������������䣬���������ƽ����Է����������ٸı�˵����Ӧ�ﵽƽ��״̬����c��ȷ��
d��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯���ǻ�ѧƽ��ı�־����d��ȷ��
�ʴ�Ϊ��cd��
��7����������õ���CO��g��+2H2��g��?CH3OH��g��
��ʼ���ʵ�����mol�� 2.5 7.5 0
�仯�����ʵ�����mol�� 2.25 4.5 2.25
ƽ������ʵ��� ��mol��0.25 3 2.25
����ѹǿ֮�ȵ����������ʵ���֮�ȣ����Դ�ʱ�����ڵ�ѹǿ�Ϳ�ʼʱ�ı�ֵΪ��0.25+3+2.25������ 2.5+7.5��=0.55��
�ʴ�Ϊ��0.55��
���� ���⿼�黯ѧ��Ӧ���ʡ�ƽ�ⳣ���ļ��㡢��˹����Ӧ�á�ԭ���ԭ���ȣ��ѶȽϴ�ע��֪ʶ�Ļ��ۣ��������ջ�ѧ����֪ʶ�ǽ���ؼ���

| A�� | ��������Һ | B�� | AgN03��Һ | C�� | ̼������Һ | D�� | ��ɫʯ����Һ |
| ѡ�� | �ı����� | ƽ���ƶ����� | �������� |
| A | ��������ˮ | �����ƶ� | ���� |
| B | �������������� | �����ƶ� | ��ǿ |
| C | ��������CH3COONa���� | �����ƶ� | ��ǿ |
| D | ��������0.1mol•L-1��ϡ���� | �����ƶ� | ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |

| A�� | a��b�Ƚϣ�bʹ���˴��� | B�� | a��b�Ƚϣ�b�¶ȸ��� | ||
| C�� | a��b�Ƚϣ�b��ѹǿ���� | D�� | a��b�Ƚϣ�b��Ӧ���ʸ��� |
| A�� | ij��Һ��NaOH��Һ���ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬˵��ԭ��Һ�д���NH4+ | |
| B�� | ij��Һ�м������������ɫ����������������ܹ�ʹ�����ʯ��ˮ����ǣ���ԭ��Һ�к�CO32- | |
| C�� | �ò�˿պȡij��Һ�ھƾ��ƵĻ���������ʱ������ʻ�ɫ��˵��ԭ��Һ��ֻ����Na+��������K+ | |
| D�� | ij��Һ�м���BaCl2��Һʱ��������ɫ��������ϡ����������ܽ⣬˵��ԭ��Һ�д���SO42- |
| A�� | �����������ԭ�ӵĵ��������λ����Ϊ6 | |
| B�� | ������������ƽ�������νṹ | |
| C�� | 4��Cl-��2��NH3���Ӿ���Pt4+��λ | |
| D�� | �������4��Cl-��Pt4+��λ����2��NH3������Pt4+����λ |