题目内容
14.现有盐酸、BaC12溶液、HClO溶液和饱和的澄清石灰水,可用一种试剂将它们直接鉴别,该试剂是( )| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
分析 盐酸溶液呈酸性,石灰水呈碱性,HClO具有强氧化性和漂白性,结合性质的异同解答该题.
解答 解:A.加入硫酸钠,与氯化钡、石灰水都生成沉淀,与盐酸、次氯酸都不反应,不能鉴别,故A错误;
B.加入硝酸银,盐酸、BaC12溶液、饱和的澄清石灰水都生成沉淀,不能鉴别,故B错误;
C.加入碳酸钠,与氯化钡、石灰水都生成沉淀,不能鉴别,故C错误;
D.滴加紫色石蕊,盐酸呈红色,氯化钡呈紫色,HClO褪色,石灰水变蓝色,可鉴别,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
4.现有下列九种物质:
①H2 ②铝 ③SiO2 ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1.
①H2 ②铝 ③SiO2 ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
(3)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1.
9.0.5mol 气态烃A 最多和1mol HCl加成,生成氯代烷B,1mol B与4mol Cl2 发生取代反应,生成只含碳、氯两种元素的化合物C,则A的分子式为( )
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
19.同温同压下,完全燃烧5L相同物质的量的甲烷和丙烷的混合气体与完全燃烧5L相同质量的乙烯和丙烯混合气体,所生成的二氧化碳质量之比为( )
| A. | 4:5 | B. | 5:3 | C. | 5:6 | D. | 6:5 |
6.除去下列物质中的杂质(括号中为杂质),所用试剂和方法错误的是( )
| A. | Cu (CuO),加盐酸,过滤 | B. | Na2CO3 (NaHCO3)固体,加热 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.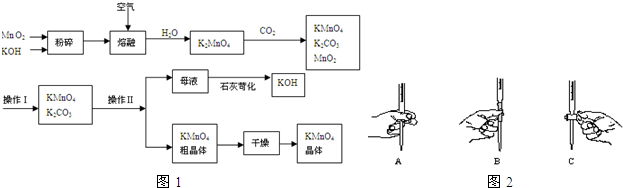
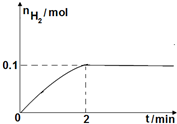 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应: