题目内容
5.下列说法中正确的是( )| A. | 某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,不含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
分析 A.氨气为碱性气体,可使红色石蕊试纸变蓝;
B.该气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子;
C.观察钾离子的焰色反应的火焰颜色时需要透过蓝色钴玻璃;
D.该沉淀可能为氯化银,原溶液中可能含有银离子.
解答 解:A.氨气为碱性气体,可使红色石蕊试纸变蓝,说明原溶液中一定含有NH4+,故A正确;
B.某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,该气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸氢根离子、亚硫酸根离子等,不一定含CO32-,故B错误;
C.用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,由于没有透过蓝色钴玻璃观察,则无法判断是否含有K+,故C错误;
D.某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,该沉淀可能为氯化银或硫酸钡,原溶液中可能存在银离子,不一定存在SO42-,故D错误;
故选A.
点评 本题开场词了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.除去下列物质中的杂质(括号中为杂质),所用试剂和方法错误的是( )
| A. | Cu (CuO),加盐酸,过滤 | B. | Na2CO3 (NaHCO3)固体,加热 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
7.下列叙述正确的是( )
| A. | 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 在常温常压下,11.2 L Cl2含有的分子数为0.5×6.02×1023 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023 | |
| D. | 标准状况下,11.2 L H2O含有的分子数为0.5×6.02×1023 |
10.实验室用电石和水反应制取的乙炔中常常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,下列实验方案最简便易行的是( )
| A. | 通过NaOH溶液后再通过浓硫酸 | B. | 通过CuSO4溶液后再通过石灰水 | ||
| C. | 通过P2O5后再通过固体NaOH | D. | 通过碱石灰 |
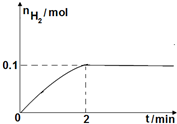 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应: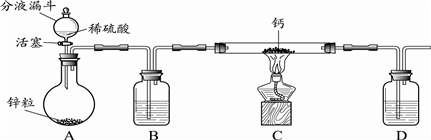
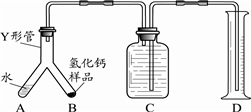
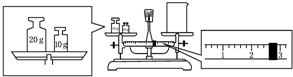 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL: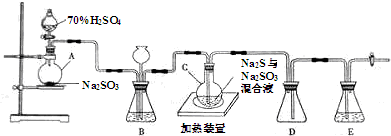
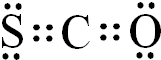 .
.