题目内容
3.温度为T1时,向容积为2L 的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol.相关数据如下:| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t 1 | t 2 | ||
(2)甲容器中,平衡时,反应放出的热量16.4kJ.
(3)T1时,反应的平衡常数K 甲=1.
(4)乙容器中,a=1.6mol.
(5)解释升高温度使CO2平衡浓度降低的原因:该反应为放热反应,升高温度,平衡向逆反应方向移动,CO2平衡浓度降低.
分析 (1)计算出△n(CO),根据v=$\frac{\frac{△n}{V}}{△t}$计算出用CO表示的平均反应速率,然后利用化学计量数关系计算出v(H2);
(2)根据反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol及平衡时消耗CO的物质的量计算放出热量;
(3)CO(g)+H2O(g)?CO2(g)+H2(g)
反应前(mol)1.2 0.6 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡时(mol)0.8 0.2 0.4 0.4
先根据c=$\frac{n}{V}$计算平衡时各组分浓度,然后根据平衡常数表达式计算出T1时反应的平衡常数K 甲;
(4)反应CO(g)+H2O(g)?CO2(g)+H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙达到平衡时CO的转化率相等,据此计算出a;
(5)该反应为放热反应,结合温度对化学平衡的影响分析.
解答 解:(1)甲容器中,反应在t1min 内消耗CO的物质的量为:1.2mol-0.8mol=0.4mol,则该时间段内用CO表示的平均反应速率为:v(CO)=$\frac{\frac{0.4mol}{2L}}{{t}_{1}min}$=$\frac{0.2}{{t}_{1}}$mol/(L•min),根据化学计量数与反应速率成正比可知:v(H2)=v(CO)=$\frac{0.2}{{t}_{1}}$mol/(L•min),
故答案为:$\frac{0.2}{{t}_{1}}$;
(2)甲容器中平衡时消耗CO的物质的量为:1.2mol-0.8mol=0.4mol,根据反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol可知平衡时放出热量为:41kJ/mol×0.4mol=16.4kJ,
故答案为:16.4;
(3)发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)
反应前(mol) 1.2 0.6 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡时(mol) 0.8 0.2 0.4 0.4
在T1达到平衡状态时甲容器中,c(CO)=$\frac{0.8mol}{2L}$0.4mol/L、c(H2O)=$\frac{0.2mol}{2L}$=0.1mol/L、c(CO2)=$\frac{0.4mol}{2L}$=0.2mol/L、c(H2)=$\frac{0.4mol}{2L}$=0.2mol/L,
则该温度下反应的平衡常数K 甲=$\frac{0.2×0.2}{0.4×0.1}$=1,
故答案为:1;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则:$\frac{0.8}{1.2}$=$\frac{a}{2.4}$,解得:a=1.6,
故答案为:1.6;
(5)反应CO(g)+H2O(g)?CO2(g)+H2(g)焓变小于0,为放热反应,升高温度后平衡向着逆向移动,导致二氧化碳的浓度减小,
故答案为:该反应为放热反应,升高温度,平衡向逆反应方向移动,CO2平衡浓度降低.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率、化学平衡常数、等效平衡、化学平衡及其影响等知识,注意掌握化学反应速率、化学平衡常数的概念及表达式,明确化学平衡及其影响,试题知识点较多,充分考查了学生的分析能力及化学计算能力.

| A. | 0.9molH2SO4 | B. | 1000mL H2O | C. | 64 g Cu | D. | 1 g CaCO3 |
| 溶质 溶解度 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 170 | 9.2 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
①水中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
②液氨中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
③水中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
④液氨中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
判断上述反应能发生的是( )
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向浓度均为0.1mol•L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 硝酸银溶液中加足量的NaCl溶液,再加KI溶液 | 先得到白色沉淀后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | 相同时间内,HA收集到的氢气多 | HA是弱酸 |
| D | 用洁净的铂丝蘸待测液进行焰色反应 | 火焰呈黄色 | 溶液中含Na+,不含K+ |
| A. | A | B. | B | C. | C | D. | D |
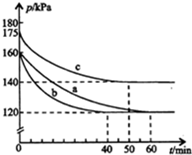 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )| A. | Q<0 | |
| B. | 与实验a相比,实验b加入了催化剂 | |
| C. | 实验b条件下,该反应的平衡常数K=2 | |
| D. | 实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=4.0×10-3mol/(L•min) |

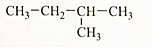
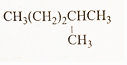 (4)
(4)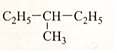 (5)(CH3)2CH-CH2-CH2-CH3.
(5)(CH3)2CH-CH2-CH2-CH3.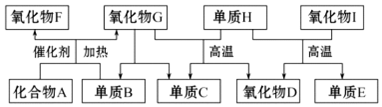
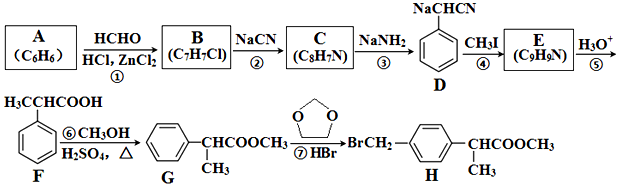
 +HCHO+HCl $\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl $\stackrel{ZnCl_{2}}{→}$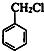 +H2O;反应⑥的化学方程式为
+H2O;反应⑥的化学方程式为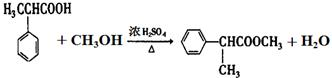 .
.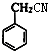 ;E的结构简式为
;E的结构简式为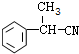 .
. .
.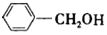 合成
合成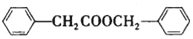 的合成
的合成 .
.