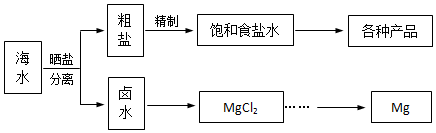
题目内容
13.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海洋植物中提取碘的流程如图:
某化学兴趣小组将上述流程②③设计成如图所示实验.
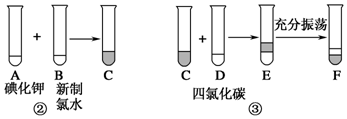
已知:②中发生反应的化学方程式为Cl2+2KI═2KCl+I2.
(1)写出提取流程中①③实验操作的名称:①过滤,③萃取分液.
(2)F中下层液体的颜色为紫色,上层液体中溶质的主要成分为KCl.
(3)从F中得到碘单质还需进行的操作是分液蒸馏.
分析 海藻灼烧得到海藻灰,浸泡得到悬浊液,过滤得到含I-离子的溶液通入氯气,氧化碘离子为碘单质,加入四氯化碳萃取剂分液,得到含碘单质的四氯化碳溶液,从有机溶液中提取碘,需要蒸馏操作;
(1)分析可知操作①为过滤,③为萃取分液;
(2)四氯化碳是无色液体,密度比水大,碘单质溶于四氯化碳后分层,下层为紫色溶液,上层为氯化钾溶液;
(3)四氯化碳中的碘单质可以利用蒸馏的方法得到碘单质晶体.
解答 解:(1)海藻灼烧得到海藻灰,浸泡得到悬浊液,过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,过滤得到含I-离子的溶液通入氯气,氧化碘离子为碘单质,将碘水中的碘单质萃取出来,选择合适的萃取剂即可,加入四氯化碳萃取剂分液,得到含碘单质的四氯化碳溶液,从有机溶液中提取碘,
故答案为:过滤;萃取分液;
(2)四氯化碳是无色液体,密度比水大,碘单质溶于四氯化碳后分层,下层为溶解碘单质的紫色溶液,上层为溶解氯化钾的溶液,
故答案为:紫;KCl;
(3)分液后从有机溶剂中提取碘,需要用蒸馏操作,故答案为:分液蒸馏.
点评 本题考查了物质的分离和提纯,题目难度不大,掌握过滤、萃取、蒸馏等操作方法是解答本题的关键,注意明确采用萃取操作时,萃取剂的选择原则.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸除去[已知:Ksp(CaCO3)=1×1010,Ksp(CaSO4)=9×10-6].下列说法错误的是( )
| A. | 温度升高,Na2CO3溶液的Ksp和c(OH-)均会增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下,CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的悬浊液中,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=9×104 |
4.二氧化碳和钠在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石).设NA为阿伏加德罗常数的值,下列有关此反应的叙述不正确的是( )
| A. | 金刚石和石墨互为同素异形体 | |
| B. | Na的还原性强于金刚石 | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.2NA |
8.下列关于物质的用途或说法不正确的是( )
| A. | 氧化铝熔点很高,可用作耐火材料 | |
| B. | 铝热反应原理是炼铁最常用的反应原理 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
18.下列有关化学概念的判断,正确的是( )
| A. | SO2和SO3互为同分异构体 | |
| B. | 二氧化碳和干冰互为同素异形体 | |
| C. | CH3CH2OH和 CH3-O-CH3 互为同分异构体 | |
| D. | 红磷和白磷互为同位素 |
5.下列说法不正确的是( )
| A. | 煤、石油、天然气均为化石燃料,它们属于不可再生资源 | |
| B. | 植物燃料燃烧时放出的能量来源于太阳能 | |
| C. | 氢气是具有热值高、无污染等优点的燃料 | |
| D. | 煤燃烧是化学能只转化为热能的过程 |
2. 利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )
利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )
 利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )
利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )| A. | 物质NBD比Q稳定 | |
| B. | NBD和Q互为同分异构体 | |
| C. | 物质NBD和Q的核磁共振氢谱图都有3个峰,但峰面积不同 | |
| D. | 一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应 |
3.温度为T1时,向容积为2L 的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol.相关数据如下:
(1)甲容器中,反应在t1min 内的平均速率v(H2)=$\frac{0.2}{{t}_{1}}$mol/(L•min).
(2)甲容器中,平衡时,反应放出的热量16.4kJ.
(3)T1时,反应的平衡常数K 甲=1.
(4)乙容器中,a=1.6mol.
(5)解释升高温度使CO2平衡浓度降低的原因:该反应为放热反应,升高温度,平衡向逆反应方向移动,CO2平衡浓度降低.
| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t 1 | t 2 | ||
(2)甲容器中,平衡时,反应放出的热量16.4kJ.
(3)T1时,反应的平衡常数K 甲=1.
(4)乙容器中,a=1.6mol.
(5)解释升高温度使CO2平衡浓度降低的原因:该反应为放热反应,升高温度,平衡向逆反应方向移动,CO2平衡浓度降低.