题目内容
5.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
分析 ①碳酸钠与盐酸反应生成氯化钠;
②Fe与硫酸铜反应生成硫酸亚铁和Cu;
③CO2与NaOH反应,而氢气不能;
④CaCO3不溶于水,NaNO3溶于水.
解答 解:①碳酸钠与盐酸反应生成氯化钠,然后蒸发可除去,故正确;
②Fe与硫酸铜反应生成硫酸亚铁和Cu,则加入过量铁粉并过滤可除杂,故正确;
③CO2与NaOH反应,而氢气不能,则依次通过盛有NaOH溶液和浓硫酸的洗气瓶可分离,故正确;
④CaCO3不溶于水,NaNO3溶于水,则溶于水、过滤可分离,与盐酸反应引入新杂质氯化钙,故错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
15.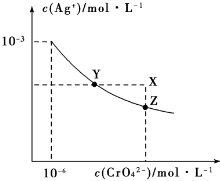 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点 | |
| B. | 在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃ | |
| C. | 向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点 | |
| D. | 在t℃时,Ag2CrO4的Ksp为1×10-9 |
16.已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是( )
| A. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,当两种沉淀共存时,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | AgCl不溶于水,不能转化为AgI |
10.若取等质量的铝粉分别与足量的稀盐酸和NaOH溶液反应,所得氢气的体积在同样条件下相比( )
| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
17.下列化学用语正确的是( )
| A. | Na2O2的电子式: | B. | Cl原子的结构示意图: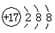 | ||
| C. | HClO分子的结构式:H-Cl-O | D. | 乙烯的结构简式:CH2CH2 |
15.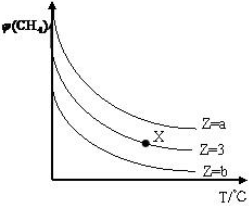 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |

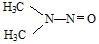 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.