题目内容
18.下列各组物质在溶液中反应时,以任意比混合均能用同一离子方程式表示的是( )| A. | AlCl3溶液和NaOH溶液 | B. | Ba(OH)2溶液与稀硫酸 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Fe和稀硝酸 |
分析 A.氢氧化钠不足时生成氢氧化铝沉淀和氯化钠,氢氧化钠过量时生成偏铝酸钠和水;
B.无论二者谁过量,反应都生成硫酸钡和水;
C.HCl少量生成碳酸氢钠和NaCl,HCl过量时生成氯化钠、水、二氧化碳;
D.Fe少量时生成硝酸铁,Fe过量时生成硝酸亚铁.
解答 解:A.AlCl3中加入少量NaOH生成Al(OH)3沉淀,反应的离子方程式为:Al3++3OH-═Al(OH)3↓,氢氧化钠过量时生成偏铝酸钠,反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,反应物的量不同时离子反应不同,故A错误;
B.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,反应产物与反应物的量无关,则以任意比混合均能用同一离子方程式表示,故B正确;
C.HCl少量生成碳酸氢钠和NaCl,离子反应为CO32-+H+=HCO3-,HCl过量时生成氯化钠、水、二氧化碳,离子反应为CO32-+2H+=CO2↑+H2O,离子反应不同,故C错误;
D.Fe少量时生成硝酸铁,离子反应为Fe+N03-+4H+=Fe3++2H20+NO↑,Fe过量时生成硝酸亚铁,离子反应为3Fe+2N03-+8H+=3Fe2++4H20+2NO↑,离子反应不同,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,明确发生的化学反应为解答的关键,为高考常见题型,侧重与量有关的离子反应的考查,题目难度不大.

练习册系列答案
相关题目
13.我国的四大发明之一黑火药,爆炸时的主要反应是:S+2KNO3+3C═K2S+3CO2↑+N2↑,下列说法不正确的是( )
| A. | 每生成0.5 mol N2,反应中转移6 mol电子 | |
| B. | 硝酸钾、硫磺在黑火药爆炸的反应中是氧化剂 | |
| C. | KNO3有强氧化性,乘坐汽车、火车、飞机时不能随身携带 | |
| D. | 上述反应的生成物都是无毒的,所以燃放爆竹时不会污染环境 |
6.下列物质中通过形成共价键使所有原子最外层均达到8电子稳定结构的是( )
| A. | NH3 | B. | NaCl | C. | PCl5 | D. | N2 |
13.下列试剂不能吸收大量溴的是( )
| A. | 四氯化碳 | B. | 碘化钾溶液 | C. | 盐酸 | D. | 碳酸钠溶液 |
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均不能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀NHO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
7.下列反应的离子方程式书写正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| C. | 向盐酸中滴加氨水:H++OH-═H2O | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
8.下列实验方法或操作不能达到实验目的是( )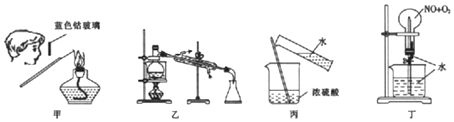

| A. | 通过图甲操作进行钾元索的焰色反应实验 | |
| B. | .用图乙装置制取蒸馏水 | |
| C. | 通过图丙操作将浓硫酸稀释为稀硫酸 | |
| D. | .用图丁装里进行喷泉实验,其中n(NO):n(O2)=4:3 |
 某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答:
某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答: