题目内容
8.下列实验方法或操作不能达到实验目的是( )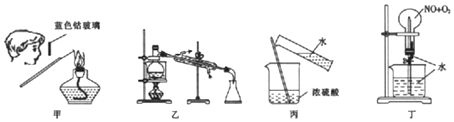
| A. | 通过图甲操作进行钾元索的焰色反应实验 | |
| B. | .用图乙装置制取蒸馏水 | |
| C. | 通过图丙操作将浓硫酸稀释为稀硫酸 | |
| D. | .用图丁装里进行喷泉实验,其中n(NO):n(O2)=4:3 |
分析 A.观察K的焰色反应透过蓝色的钴玻璃;
B.水的沸点较低,蒸馏可制备;
C.浓硫酸稀释为稀硫酸,将密度大的液体注入密度小的液体中,并不断搅拌;
D.喷泉实验发生4NO+3O2+2H2O=4HNO3,水充满烧瓶.
解答 解:A.观察K的焰色反应透过蓝色的钴玻璃,图中操作合理,故A正确;
B.水的沸点较低,蒸馏可制备,图中蒸馏实验装置合理,故B正确;
C.浓硫酸稀释为稀硫酸,将密度大的液体注入密度小的液体中,并不断搅拌,应将浓硫酸注入水中,操作不合理,故C错误;
D.喷泉实验发生4NO+3O2+2H2O=4HNO3,水充满烧瓶,则n(NO):n(O2)=4:3,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、焰色反应、混合物分离、喷泉实验、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意实验的评价性分析.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
18.下列各组物质在溶液中反应时,以任意比混合均能用同一离子方程式表示的是( )
| A. | AlCl3溶液和NaOH溶液 | B. | Ba(OH)2溶液与稀硫酸 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Fe和稀硝酸 |
19.已知充分燃烧a g乙炔(C2H2)气体时生成2mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧热的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-b kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| D. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-2b kJ/mol |
16.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)?4C(g)+5D(g).若经5s后,剩下A 2mol,则A的反应速率是( )
| A. | 0.4 mol/(L•s) | B. | 1mol/(L•s) | C. | 0.5 mol/(L•s) | D. | 0.2 mol/(L•s) |
13.下列过程吸收热量的是( )
| A. | 钠和水反应 | B. | 铝热反应 | C. | 液氨气化 | D. | 镁条燃烧 |
20.下列说法正确的是( )
| A. | 在铁片上镀锌,铁片与电源的正极相连 | |
| B. | 合成氨工业中,降温使NH3液化,可以加快反应速率 | |
| C. | 向氨水中不断通入CO2,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 工业生产硫酸时,使用热交换器可以提高能量的利用率与原料的转化率 |
17.短周期主族元素X、Y、Z、W的原子序数依次增大,其中原子半径$\frac{r(Z)}{r(X)}$的比值在短周期主族元素中为最大值,而W的原子核外电子数是同主族元素Y的2倍.则下列说法正确的是( )
| A. | 简单离子半径:Z>Y | |
| B. | X可分别与Y、Z、W组成共价化合物 | |
| C. | W的最高价含氧酸的酸式盐一定显酸性 | |
| D. | ZYX溶液与ZXW溶液呈碱性的原理相同 |
13.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 将碘水和四氯化碳的混合溶液置于分液漏斗中并振荡、静置.溶液分层,上层呈紫红色,下层几乎无色. | 碘在四氯化碳中的溶解度大于在水中的溶解度 |
| B | 将表面滴有几滴水的蔗糖和一定量的浓硫酸混合并搅拌.蔗糖膨胀变黑,产生有刺激性 气味的气体. | 浓硫酸具有脱水性和强氧化性 |
| C | 在稀硝酸和过量的铜片反应后的溶液中,滴入少量稀硫酸.剩余铜继续溶解,并有气泡产生. | 稀硫酸也可将铜氧化 |
| D | 用洁净的铂丝蘸取某盐溶液在酒精灯火焰上灼烧.观察到酒精灯火焰呈黄色. | 盐溶液中一定含有 Na+,无 K+ |
| A. | A | B. | B | C. | C | D. | D |