题目内容
16.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL 1mol/L的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A. | 实验①反应后溶液中含有Fe3+、Fe2+、Cu2+ | |
| B. | 实验②③反应后剩余固体全部是Cu | |
| C. | 实验④的滤液中c(Fe2+)=1.5 mol/L | |
| D. | 原粉末样品中m(Fe):m(Cu)=7:8 |
分析 铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
利用②的数据,设Cu、Fe合金中金属物质的量分别为xmol、ymol.
Fe+2Fe3+=3Fe2+
x 2x
Cu+2Fe3+=Cu2++2Fe2+
0.02-x 0.04-2x
依据铜元素守恒 (0.02-x)+$\frac{0.64}{64}$=y;质量守恒 56x+64y=1.8.联立解之得:x=y=0.015;
第③组实验中溶解金属为3.60g-2.48g=1.12g,Fe3+恰好完全反应,Cu不反应,Fe可能过量;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;据此分别分析各选项选择即可.
解答 解:铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
利用②的数据,设Cu、Fe合金中金属物质的量分别为xmol、ymol.
Fe+2Fe3+=3Fe2+
x 2x
Cu+2Fe3+=Cu2++2Fe2+
0.02-x 0.04-2x
依据铜元素守恒:(0.02-x)+$\frac{0.64}{64}$=y;质量守恒 56x+64y=1.8.联立解之得:x=y=0.015;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混Fe3+恰好完全反应,Cu不反应,Fe可能过量;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;
A.依据分析可知,实验①反应后溶液中含有Fe3+、Fe2+、Cu2+,故A正确;
B.依据分析可知:实验②反应后剩余固体全部是Cu,③反应后剩余固体中含有Cu,可能含有Fe,故B错误;
C.第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2,则溶液中存在c(Fe2+)=$\frac{1}{2}$c(Cl-)=$\frac{3}{2}$c(FeCl3)=$\frac{3}{2}$×1mol/L=1.5 mol/L,故C正确;
D.由分析可知,1.80g原混合物中Fe、Cu均为0.015mol,则混合物中m(Fe):m(Cu)=0.015mol×56g/mol:0.015mol×64g/mol=7:8,故D正确;
故选B.
点评 本题考查混合物的计算,明确物质反应先后顺序及各组剩余固体成分是解本题关键,再结合转移电子守恒、原子守恒进行解答,同时考查学生思维缜密性,题目难度中等.

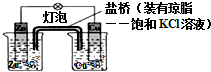
| A. | 正极表面出现气泡 | B. | 电池反应:Zn+Cu2+=Zn2++Cu | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 盐桥中K+移向ZnSO4溶液 |
| A. | 该电池的电流方向是由锌到二氧化猛 | |
| B. | 该电池反应中MnO2起催化作用 | |
| C. | 当0.1molZn完全溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 电池正极反应为MnO2+e-+H2O═MnO(OH)+OH- |
| A. | 根据能量守恒定律,反应物能量之和等于生成物能量之和 | |
| B. | 化学反应一定伴随能量变化,有能量变化也一定伴随化学反应 | |
| C. | 反应物所具有的总能量比生成物所具有的总能量高的反应是放热反应 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |

| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡 | |
| B. | 实验II:实验室制取并收集氨气 | |
| C. | 实验III:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去 |




 .
.