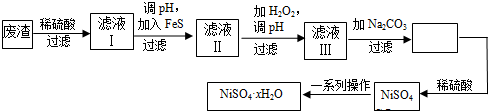
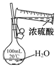
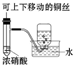
题目内容
6.对于实验I~IV的实验现象预测正确的是( )
| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡 | |
| B. | 实验II:实验室制取并收集氨气 | |
| C. | 实验III:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去 |
分析 A.先发生碳酸钠与盐酸的反应生成碳酸氢钠;
B.反应生成水,水易倒流导致试管炸裂;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色.
解答 解:A.碳酸氢钠优先与盐酸反应生成碳酸氢钠,则开始没有气泡,故A错误;
B.氢氧化钙与氯化铵的反应中生成水,水易倒流,则图中试管口应向下倾斜,故B错误;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作,不需要坩埚,应选蒸发皿,故C错误;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色,观察到性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及蒸发、氨气制备、碳酸钠与碳酸氢钠的性质等知识,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.

练习册系列答案
相关题目
16.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL 1mol/L的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A. | 实验①反应后溶液中含有Fe3+、Fe2+、Cu2+ | |
| B. | 实验②③反应后剩余固体全部是Cu | |
| C. | 实验④的滤液中c(Fe2+)=1.5 mol/L | |
| D. | 原粉末样品中m(Fe):m(Cu)=7:8 |
17.下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
14.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L H2O中所含的原子总数为0.3NA | |
| B. | 0.1 molCl2与足量的NaOH稀溶液反应,转移的电子总数为0.2NA | |
| C. | 1mol•L一1的NaCl溶液中所含Na+数目为NA | |
| D. | 常温常压下,14g由N2和CO组成的混合气体中含有的原子总数为NA |
15.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 氯化钠(硝酸钾) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ②③ | B. | ①③ | C. | 只有③ | D. | ③④ |
16.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是( )
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
 已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断:
已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断: