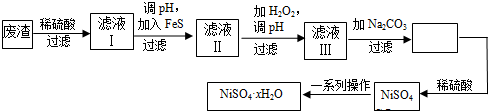
题目内容
1.氯、溴、碘单质的氧化性强弱顺序是,因此工业上从海水中提取溴可选用做氧化剂,反应的离子方程式是Cl2+2Br-=2Cl-+Br2 ,将溴水加入足量KI溶液中,充分反应后,再加入少许四氯化碳,振荡后静置,出现的现象是上层溶液接近无色,下层溶液呈紫红色.分析 根据氯气的氧化性比溴单质强,所以 工业上从海水中提取溴可选用做氧化剂氯气,离子反应方程式为:Cl2+2Br-=2Cl-+Br2 ,溴水加入KI溶液中振荡,发生Br2+2KI═2KBr+I2,加CCl4,溶液分层,四氯化碳的密度比水大,有色层在下层,以此来解答.
解答 解:根据氯气的氧化性比溴单质强,所以 工业上从海水中提取溴可选用做氧化剂氯气,离子反应方程式为:Cl2+2Br-=2Cl-+Br2 ,溴水加入KI溶液中振荡,发生Br2+2KI═2KBr+I2,加CCl4,溶液分层,四氯化碳的密度比水大,有色层在下层,所以现象为溶液分层,四氯化碳的密度比水大,有色层在下层,下层为紫红色,故答案为:Cl2+2Br-=2Cl-+Br2 ;上层溶液接近无色,下层溶液呈紫红色.
点评 本题考查卤素单质的置换反应及萃取,明确氧化性的强弱及萃取、分液中萃取剂的选择、密度等知识即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列关于用惰性电极电解KNO3溶液的叙述正确的是( )
| A. | 随着电解的进行,溶液的pH减小 | |
| B. | OH-向阳极移动,阳极附近溶液呈碱性 | |
| C. | 阴极上H+得电子被还原成H2 | |
| D. | NO3-向阳极移动,K+向阴极移动,分别在对应的电极上析出 |
16.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL 1mol/L的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A. | 实验①反应后溶液中含有Fe3+、Fe2+、Cu2+ | |
| B. | 实验②③反应后剩余固体全部是Cu | |
| C. | 实验④的滤液中c(Fe2+)=1.5 mol/L | |
| D. | 原粉末样品中m(Fe):m(Cu)=7:8 |
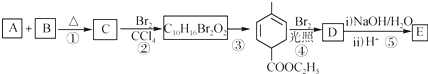
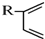 +
+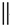 $\stackrel{△}{→}$
$\stackrel{△}{→}$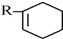
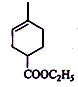 +Br2→
+Br2→ .
.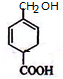 .
.
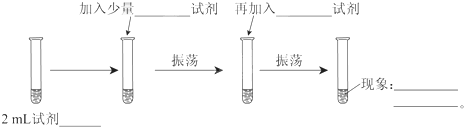
 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.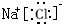
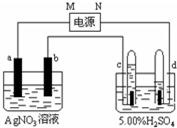 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.试管充满水,通电一段时间后,在c、d两极上共收集到标准状态下336mL气体,体积如图所示.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.试管充满水,通电一段时间后,在c、d两极上共收集到标准状态下336mL气体,体积如图所示.请回答下列问题.