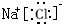题目内容
8.请比较下列性质的强弱或大小(填“<”或“>”)①金属性:Li< K ②非金属性:N> P
③碱性:Mg(OH)2> Al(OH)3 ④酸性:H2CO3> H2SiO3
⑤半径:F-> Na+ ⑥稳定性:H2S< HCl.
分析 ①同主族从上到下金属性增强;
②同主族从上到下非金属性减弱;
③同周期从左向右金属性减弱,金属性越强,对应最高价氧化物的水化物的碱性越强;
④同周期从左向右非金属性增强,非金属性越强,对应最高价氧化物的水化物的酸性越强;
⑤具有相同电子排布的离子,原子序数大的离子半径小;
⑥非金属性越强,对应氢化物越稳定.
解答 解:①同主族从上到下金属性增强,则金属性Li<K,故答案为:<;
②同主族从上到下非金属性减弱,则非金属性:N>P,故答案为:>;
③同周期从左向右金属性减弱,金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:Mg(OH)2>Al(OH)3,故答案为:>;
④同周期从左向右非金属性增强,非金属性越强,对应最高价氧化物的水化物的酸性越强,酸性:H2CO3>H2SiO3,故答案为:>;
⑤具有相同电子排布的离子,原子序数大的离子半径小,则半径:F->Na+,故答案为:>;
⑥非金属性越强,对应氢化物越稳定,则稳定性:H2S<HCl,故答案为:<.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
19.下列实验操作正确的是( )
| A. | 排水法收集气体后,先熄灭酒精灯,再取出导气管 | |
| B. | 蒸馏自来水时,冷凝水从上口进,从下口出 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
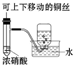
| D. | 稀释浓硫酸时,应将浓硫酸慢慢加入水中并及时搅拌 |
16.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL 1mol/L的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A. | 实验①反应后溶液中含有Fe3+、Fe2+、Cu2+ | |
| B. | 实验②③反应后剩余固体全部是Cu | |
| C. | 实验④的滤液中c(Fe2+)=1.5 mol/L | |
| D. | 原粉末样品中m(Fe):m(Cu)=7:8 |
3. 普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
 普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )| A. | 外电路上,电子由Cu电极沿导线流入Ag2O电极 | |
| B. | 测量原理示意图中,Ag2O为负极 | |
| C. | 负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O | |
| D. | 电池工作时,OH-向正极移动 |
17.下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.