题目内容
7.被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在另一边镀二氧化锰.在纸内是离子“流过”水和氧化锌组成的电解液.电池总反应Zn+2MnO2+H2O═ZnO+2MnO(OH),下列说法正确的是( )| A. | 该电池的电流方向是由锌到二氧化猛 | |
| B. | 该电池反应中MnO2起催化作用 | |
| C. | 当0.1molZn完全溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 电池正极反应为MnO2+e-+H2O═MnO(OH)+OH- |
分析 该装置为原电池,锌易失电子而作负极,二氧化锰作正极,负极上电极反应式为:Zn-2e-+2OH-=ZnO+H2O;MnO2被还原,为原电池的正极,电极反应为MnO2+H2O+e-=MnO(OH)+OH-,结合锌和转移电子之间的关系式解答.
解答 解:A.该装置中,锌元素化合价由0价变为+2价,所以锌作负极,电子从负极流出,电流是从正极流向负极锌,故A错误;
B.该反应中,锰元素化合价由+4价变为+2价,所以二氧化锰作正极,故B错误;
C.电子不进入电解质溶液,故C错误;
D.正极上二氧化锰得电子和水反应,电极反应式为MnO2+H2O+e-═MnO(OH)+OH-,故D正确;
故选D.
点评 本题考查了化学电源新型电池,根据元素化合价变化判断正负极材料,结合电解质溶液书写电极反应式,易错选项是C,注意电子不进入电解质溶液,溶液中自由离子的定向移动形成电流,为易错点.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
20.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol•L-1•s-1”所表示的意思是:时间为1 s时,某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应现象越明显,反应速率越大 |
18.用下列三种装置制备和收集二氧化碳气体:

将收集的三瓶CO2置于天平上称量,若三个集气瓶的体积与质量均相等,称量结果正确的是( )

将收集的三瓶CO2置于天平上称量,若三个集气瓶的体积与质量均相等,称量结果正确的是( )
| A. | ①最重 | B. | ②最重 | C. | ③最重 | D. | ①②③一样重 |
2.下列说法正确的是( )
| A. | 胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 | |
| B. | 在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距 | |
| C. | 道尔顿、阿伏伽德罗、卢瑟福、波尔等科学家的研究不断更新人们对原子结构的认识 | |
| D. | 确定物质中是否含有C、H、O、N、Cl、Br、S等元素可用元素分析仪,确定物质中是否含有哪些金属元素可用原子吸收光谱 |
19.下列实验操作正确的是( )
| A. | 排水法收集气体后,先熄灭酒精灯,再取出导气管 | |
| B. | 蒸馏自来水时,冷凝水从上口进,从下口出 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 稀释浓硫酸时,应将浓硫酸慢慢加入水中并及时搅拌 |
16.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL 1mol/L的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A. | 实验①反应后溶液中含有Fe3+、Fe2+、Cu2+ | |
| B. | 实验②③反应后剩余固体全部是Cu | |
| C. | 实验④的滤液中c(Fe2+)=1.5 mol/L | |
| D. | 原粉末样品中m(Fe):m(Cu)=7:8 |
17.下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
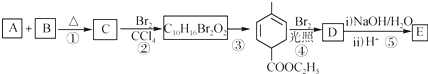
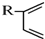 +
+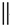 $\stackrel{△}{→}$
$\stackrel{△}{→}$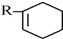
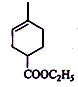 +Br2→
+Br2→ .
.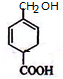 .
.