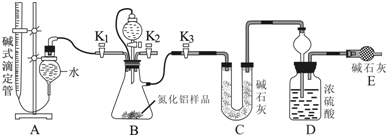
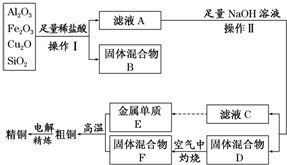
题目内容
1.氨、硝酸、硝酸铵、硝酸铜是重要的化工产品,工业合成氨与制备硝酸一般可连续生产,流程如图,请回答下列问题: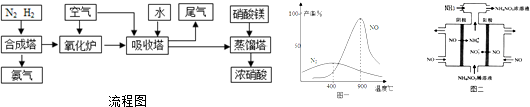
(1)吸收塔中通入空气的作用是将NO、NO2等氧化为硝酸;下列可以代替硝酸镁加入到蒸馏塔中的是A.
A.浓硫酸 B.氯化钙 C.生石灰 D.硝酸亚铁
(2)制硝酸尾气中的氮氧化物常用尿素[CO(NH2)2]作为吸收剂,其主要的反应为:NO、NO2混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2和N2,反应的化学方程式:NO+NO2+H2O=2HNO2、CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O.
(3)在氧化炉里,催化剂存在时氨气和氧气反应:4NH3+5O2═4NO+6H2O 4NH3+3O2═2N2+6H2O在不同温度时生成产物如图一所示.在氧化炉里,反应温度通常控制在800℃~900℃的理由是800~900℃时副产物N2的产率较低,NO的产率很高.
(4)如图二所示装置可用于电解NO制备 NH4NO3,电解总反应方程式为8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,需补充氨气的理由是将电解过程中生成的硝酸转化为硝酸铵.
(5)工业上通常用铜与浓硝酸反应制得光谱纯硝酸铜晶体(化学式为Cu(NO3)2•3H2O,摩尔质量为242g/mol).
已知:25℃、1.01×105Pa时,在密闭容器发生反应:2NO2?N2O4,达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L.现用一定量的Cu与足量的浓高纯度硝酸反应,制得5.00L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105Pa),理论上生成光谱纯硝酸铜晶体的质量为36.3 g.
分析 工业制硝酸的流程图分析:1、在合成塔中,N2与H2化合生成NH3.2、在氧化炉里,NH3与空气中的O2反应,被氧化成NO、NO2.3、在吸收塔中,氧化炉中产生的NO、NO2气体与空气中的O2、通入的H2O反应生成硝酸.4、在蒸馏塔中,从吸收塔中过来硝酸中加入硝酸镁,进行浓缩处理,从而制得浓硝酸.
解答 解:(1)吸收塔主要吸收二氧化氮生成硝酸.另外从氧化炉里过来的气体中有NO,通入空气,可以将NO氧化为NO2,然后再与NO2、H2O反应生成HNO3;加入硝酸镁的作用是吸收水,而且不与硝酸反应,从而达到浓缩的目的.可以用浓硫酸来代替,既可以吸收水分,不易挥发,也不与硝酸反应.
故答案为:将NO、NO2等氧化为硝酸;A;
(2)由反应物和产物及质量守恒定律可知发生的反应为NO+NO2+H2O=2HNO2、CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O,
故答案为:NO+NO2+H2O=2HNO2;CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O;
(3)由所给图表,发现在800~900℃时,主产物NO的产率很高,而副产物N2的产率很低,
故答案为:800~900℃时副产物N2的产率较低,NO的产率很高;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此要使电解产物全部转化为NH4NO3,需补充NH3.
故答案为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3;将电解过程中生成的硝酸转化为硝酸铵;
(5)根据达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L,故5L混合气体中的NO2的物质的量n=CV=0.04mol/L×5L=0.2mol,
N2O4的物质的量n=CV=0.01mol/L×5L=0.05mol.
设反应物铜的物质的量为xmol,根据铜与浓硝酸反应时得失电子数守恒,即铜失去的电子的物质的量等于硝酸得到的电子的物质的量,可得:
2x=0.2mol×1+0.05mol×2
解得x=0.15mol
而Cu~Cu(NO3)2•3H2O,故生成的Cu(NO3)2•3H2O的物质的量为0.15mol,故质量m=nM=0.15mol×242g/mol=36.3g,
故答案为:36.3.
点评 本题考查了工业合成氨与制备硝酸、化学方程式的书写、电解原理的应用、守恒方法在化学计算中的应用的知识,题目综合性较强,难度中等,侧重于考查学生的分析能力和计算能力、以及对基础知识的综合应用能力.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
O3+Cl→ClO+O2△H1
ClO+O→Cl+O2△H2
破坏臭氧层的总反应是:O3+O→2O2 △H
该反应的能量变化示意图如图所示:
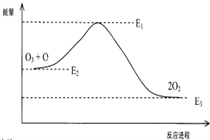
则下列叙述不正确的是( )
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
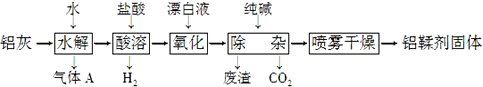
下列说法错误的是( )
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚.
| A. | ①②④⑥ | B. | ①③ | C. | ②④⑤⑥ | D. | ③⑤ |