题目内容
15.工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).(1)实验原理:①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气.写出Al4C3与硫酸反应的化学方程AlN+NaOH+H2O=NaAlO2+NH3↑.
(2)实验装置(如图所示):
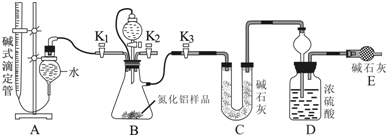
(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL;
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应;
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH,与装置B瓶内物质充分反应;
④打开K2,通入空气一段时间 (填入该步应进行的操作);
⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L•mol-1)
①Al4C3的质量分数为$\frac{0.048(a-b)}{{V}_{m}x}$×100%;
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积偏小 (填“偏大”、“偏小”或“无影响”下同).若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积偏大;
③AlN的质量分数为$\frac{41(z-y)}{17x}$×100%.
分析 从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数,以此分析解答;
(1)②根据题目信息:AlN溶于强碱溶液时会生成NH3来书写方程式;
(3)④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收;
(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小;如果装置没有橡胶管,随液体流下试管中压强增大,在排液过程中会排出的液体增多,导致测定结果偏高;
③根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,可求得Al4C3的质量分数.
解答 解:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;
(1)根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小,
故答案为:打开K2,通入空气一段时间;
(4)①甲烷的体积为(a-b)mL,物质的量为$\frac{(a-b)×1{0}^{-3}}{{V}_{m}}$mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为$\frac{1}{3}$×$\frac{(a-b)×1{0}^{-3}}{{V}_{m}}$mol×144g/mol=$\frac{48(a-b)×1{0}^{-3}}{{V}_{m}}$g,Al4C3的质量分数为$\frac{0.048(a-b)}{{V}_{m}x}$×100%,
故答案为:$\frac{0.048(a-b)}{{V}_{m}x}$×100%.
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,橡胶管可以平衡压强让液体顺利滴入试管中,还可以起到降低实验误差的作用,如果装置中没有橡胶管,随液体流下试管中压强增大,试管中排出液体增多,测量出的该物质百分含量将会偏大,
故答案为:偏小;偏大;
③氨气的质量为(z-y)g,物质的量为$\frac{z-y}{17}$mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为 $\frac{z-y}{17}$mol×41g/mol=$\frac{41(z-y)}{17}$g,故AlN的质量分数为 $\frac{\frac{41(z-y)}{17}}{x}$×100%=$\frac{41(z-y)}{17x}$×100%,
故答案为:$\frac{41(z-y)}{17x}$×100%.
点评 本题是一道关于物质的组成和含量测定知识的综合考查题,要求学生具有分析和解决问题的能力,题目难度较大.

| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
| A. | 100 mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molCl2中充分燃烧,反应时转移6.02×1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500 mL 18.4 mol•L-1的硫酸中,产生H2比11.2L多 |
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网 ⑥泥三角 ⑦坩埚 ⑧铁三角架.
| A. | ②③⑤⑧ | B. | ①④⑥ | C. | ①③⑤⑧ | D. | ②③⑤⑥ |
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | 若反应物所具有的总能量小于生成物所具有的总能量,则发生的是放热反应 | |
| C. | 稀H2SO4溶液与稀Ba(OH)2溶液反应生成lmol H2O时放出的热量叫中和热 | |
| D. | 1molH2与0.5molO2反应放出的热量就是H2的燃烧热 |