题目内容
13.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下: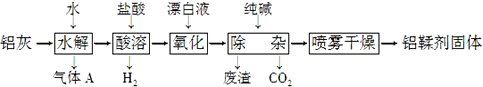
下列说法错误的是( )
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
分析 铝灰主要成分为Al、Al2O3、AlN、FeO等加入水发生反应,AlN和水反应生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液PH使铁离子全部沉淀,采用喷雾干燥制备铝鞣剂,以此解答该题.
解答 解:铝灰主要成分为Al、Al2O3、AlN、FeO等加入水发生反应,AlN和水反应生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液PH使铁离子全部沉淀,采用喷雾干燥制备铝鞣剂,
A.气体A为氨气,为碱性气体,能使湿润的红色石蕊试纸变蓝,故A正确;
B.升高温度,可增大反应速率,温度越高,氨气的溶解度越小,故B正确;
C.加入纯碱调节pH,可生成氢氧化铁沉淀,不能生成氢氧化铝,否则不能制得目标物质,故C错误;
D.如直接蒸发,加热温度过高,可导致铝离子完全水解生成氢氧化铝,故D正确.
故选C.
点评 本题以铝鞣剂提取工艺流程为载体,考查元素化合物性质及相互转化、氧化还原、实验基本操作等知识点,侧重于学生的分析、实验能力的考查,注意把握制备原理,把握物质的性质,题目难度中等.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
6.下列叙述正确的是( )
| A. | 100 mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molCl2中充分燃烧,反应时转移6.02×1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500 mL 18.4 mol•L-1的硫酸中,产生H2比11.2L多 |
8.已知断开1mol H-H键要吸收436kJ的能量,断开1mol Cl-Cl键要吸收243kJ的能量,而形成1mol H-Cl键要放出431kJ的能量,对于反应:H2+Cl2═2HCl,下列说法正确的是( )
| A. | 该反应在发生过程中要吸收能量 | |
| B. | 该反应在发生过程中要放出能量 | |
| C. | 反应后若生成2 mol HCl,则一定会放出2×431 kJ的能量 | |
| D. | 断开1 mol H-H键要吸收的能量与形成1 mol H-Cl键要放出的能量相等 |
18.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | (CH3)2CHCH2CH3 | D. | CH3C(CH3)3 |
2.在下列说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | 若反应物所具有的总能量小于生成物所具有的总能量,则发生的是放热反应 | |
| C. | 稀H2SO4溶液与稀Ba(OH)2溶液反应生成lmol H2O时放出的热量叫中和热 | |
| D. | 1molH2与0.5molO2反应放出的热量就是H2的燃烧热 |
3.下列有关概念的说法正确的是( )
| A. | H2、D2、T2互为同素异形体 | B. | 甲烷和异丁烷互为同系物 | ||
| C. | 14C和C60互为同位素 | D. | 淀粉和纤维素互为同分异构体 |