题目内容
如表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.试用元素符号、离子符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是 ;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是 ;(填化学式)
(3)元素⑦的氢化物的化学式为 ;该氢化物常温下和元素②的单质反应的化学方程式 ;
(4)①②③三种元素按原子半径由大到小的顺序排列为 (填元素符号)
(5)③和⑨两元素形成化合物的电子式 ;①和⑦两元素形成四核化合物的电子式 ,该物质与CO2反应的化学方程式 .
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是
(3)元素⑦的氢化物的化学式为
(4)①②③三种元素按原子半径由大到小的顺序排列为
(5)③和⑨两元素形成化合物的电子式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别为Na、K、Mg、Ca、Al、C、O、P、Cl、Ar元素,
(1)稀有气体原子最外层达到稳定结构,所以稀有气体化学性质最不活泼;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)元素⑦的氢化物是水,常温下,K和水反应生成KOH和氢气;
(4)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(5)③和⑨两元素形成化合物为氯化镁,氯化镁中镁离子和氯离子之间存在离子键;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键;过氧化钠和二氧化碳反应生成碳酸钠和氧气.
(1)稀有气体原子最外层达到稳定结构,所以稀有气体化学性质最不活泼;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)元素⑦的氢化物是水,常温下,K和水反应生成KOH和氢气;
(4)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(5)③和⑨两元素形成化合物为氯化镁,氯化镁中镁离子和氯离子之间存在离子键;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键;过氧化钠和二氧化碳反应生成碳酸钠和氧气.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别为Na、K、Mg、Ca、Al、C、O、P、Cl、Ar元素,
(1)稀有气体原子最外层达到稳定结构,所以稀有气体化学性质最不活泼,所以这几种元素中化学性质最不活泼的是Ar,故答案为:Ar;
(2)①③⑤三种元素金属性强弱顺序是Na>Mg>Al,所以最高价氧化物对应水化物中,碱性最强的是NaOH,故答案为:NaOH;
(3)元素⑦的氢化物是水,其化学式为H2O,常温下,K和水反应生成KOH和氢气,反应方程式为,故答案为:H2O;2K+2H2O=2KOH+H2↑;
(4)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以这三种原子半径大小顺序是K>Na>Mg,故答案为:K>Na>Mg;
(5)③和⑨两元素形成化合物为氯化镁,氯化镁中镁离子和氯离子之间存在离子键,其电子式为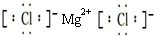 ;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,其电子式为
;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,其电子式为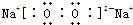 ;过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:
;过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为: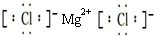 ;
;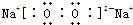 ;2Na2O2+2CO2=2Na2CO3+O2.
;2Na2O2+2CO2=2Na2CO3+O2.
(1)稀有气体原子最外层达到稳定结构,所以稀有气体化学性质最不活泼,所以这几种元素中化学性质最不活泼的是Ar,故答案为:Ar;
(2)①③⑤三种元素金属性强弱顺序是Na>Mg>Al,所以最高价氧化物对应水化物中,碱性最强的是NaOH,故答案为:NaOH;
(3)元素⑦的氢化物是水,其化学式为H2O,常温下,K和水反应生成KOH和氢气,反应方程式为,故答案为:H2O;2K+2H2O=2KOH+H2↑;
(4)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以这三种原子半径大小顺序是K>Na>Mg,故答案为:K>Na>Mg;
(5)③和⑨两元素形成化合物为氯化镁,氯化镁中镁离子和氯离子之间存在离子键,其电子式为
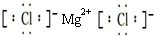 ;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,其电子式为
;①和⑦两元素形成四核化合物过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,其电子式为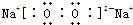 ;过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:
;过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为: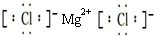 ;
;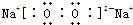 ;2Na2O2+2CO2=2Na2CO3+O2.
;2Na2O2+2CO2=2Na2CO3+O2.
点评:本题考查了元素周期表和元素周期律的综合应用,还涉及物质结构、元素化合物知识,同时考查学生对基础知识的掌握及对知识的灵活运用能力,注意过氧化钠电子式的书写,为易错点.

练习册系列答案
相关题目
一位学生在做乙醛的还原性实验时,取1mol?L-1 CuSO4 溶液和0.5mol?L-1 NaOH 溶液各1mL,在一支试管中混合后又加入0.5mL 40%乙醛溶液,结果无红色沉淀产生.实验失败的原因可能是( )
| A、加入的NaOH 不够 |
| B、加入的CuSO4 不够 |
| C、未用水浴加热 |
| D、加入的乙醛太少 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为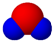 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,是国家经济发展的重要基础原材料.2005年美国科学家发现了W的“超级原子”结构-W13 |