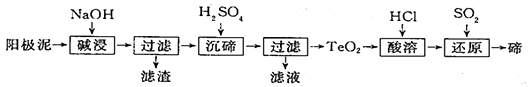
题目内容
15.如图是一个电化学过程的示意图.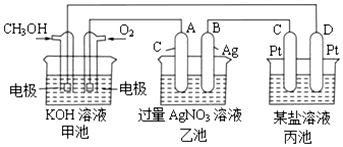
请回答下列问题:
(1)写出通入CH3OH的电极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
(2)乙池中反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为0.28L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是B、D(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液D.AgNO3溶液.
分析 图中甲池能自发进行氧化还原反应,属于原电池,通燃料的电极是负极,通氧气的电极是正极;乙池、丙池是电解池,与原电池正极相连的是阳极,与原电池负极相连的是阴极,则A是阳极,氢氧根放电;B是阴极,银离子放电;C是阳极,D是阴极,丙池中析出1.6g某金属,说明丙池中电解质是含有氧化性较强的金属阳离子在阴极得电子析出金属,据此解答.
解答 解:(1)甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═6H2O+CO32-,
故答案为:CH3OH-6e-+8OH-═6H2O+CO32-;
(2)乙池中A电极上氢氧根离子放电、阴极上银离子放电,所以乙池电池反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
B(Ag)极的质量增加5.4g时,n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,则转移电子为0.05mol,根据转移电子相等,甲池中理论上消耗O2的体积为 $\frac{0.05mol}{4}$×22.4L/mol=0.28L;
丙池某电极析出1.6g金属,说明丙池中电解质是含有氧化性较强的金属阳离子在阴极得电子析出金属,不可能是镁离子和钠离子的盐溶液,则AC错误;此时转移电子为0.05mol,若是二价金属,金属的摩尔质量是$\frac{1.6g}{\frac{0.05mol}{2}}$=64g/mol,所以电解质是含有铜离子的盐溶液,则B正确;
若是一价金属,金属的摩尔质量是32g/mol,但题目中没说丙池盐溶液足量,若AgNO3不足,只能电解出1.6gAg,之后一直电解水,所以D正确,
故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;0.28;BD.
点评 本题考查了原电池和电解池原理,为高频考点,涉及电极反应式的书写及物质的量的计算,会结合电解质溶液酸碱性书写电极反应式,再结合转移电子相等进行计算,题目难度不大.

| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 稀HNO3中加入过量的Fe 粉,充分反应后,滴入KSCN 溶液 | 溶液呈红色 | 稀HNO3将Fe 氧化为Fe3+ |
| B | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | Al 箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密了氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
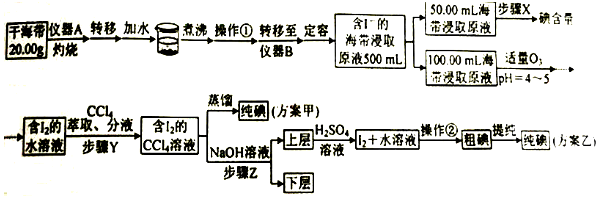
 名称为2,3-二甲基-2-丁烯.
名称为2,3-二甲基-2-丁烯.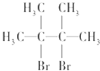 .
. .
. ;
; ;
;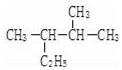 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷.
 ,
, 五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:
五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题: