题目内容
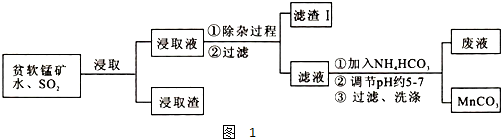
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是
②电解NaCl溶液的离子方程式是
③将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①电解饱和食盐水时,阴极上是氢离子得电子,生成氢气;
②电解NaCl溶液生成氢氧化钠、氯气和氢气;
③阳极上是氯离子失电子,生成氯气,氯气能氧化Na2S;
(2)若要在铁制品上镀一定厚度的Ag,Y为Ag,电解质为硝酸银,溶液浓度不变;
(3)根据电极方程式计算.
②电解NaCl溶液生成氢氧化钠、氯气和氢气;
③阳极上是氯离子失电子,生成氯气,氯气能氧化Na2S;
(2)若要在铁制品上镀一定厚度的Ag,Y为Ag,电解质为硝酸银,溶液浓度不变;
(3)根据电极方程式计算.
解答:
解:(1)①和电源的正极相连的电极Y极是阳极,该电极上氢氧根离子发生失电子的氧化反应,即4OH--4e-=2H2O+O2↑,氢氧根离子浓度减小,氢离子浓度增大,石蕊试液变红,故答案为:有无色气泡产生,溶液变红;
②电解NaCl溶液生成氢氧化钠、氯气和氢气,电极方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
③阳极上是氯离子失电子,生成氯气,氯气能氧化Na2S,方程式为Cl2+S2-=S↓+2Cl-,故答案为:Cl2+S2-=S↓+2Cl-;
(2)若要在铁制品上镀一定厚度的Ag,Y为Ag,发生氧化反应,电极方程式为Ag-e-=Ag+,电解质为硝酸银,溶液浓度不变,故答案为:Ag-e-=Ag+;不变;
(3)氯气的物质的量为:n(Cl2)=
=0.05mol,则n(M2+)=0.05mol,金属的摩尔质量为:M=
=
=64g/mol,故答案为:64g/mol.
②电解NaCl溶液生成氢氧化钠、氯气和氢气,电极方程式为2Cl-+2H2O
| ||
| ||
③阳极上是氯离子失电子,生成氯气,氯气能氧化Na2S,方程式为Cl2+S2-=S↓+2Cl-,故答案为:Cl2+S2-=S↓+2Cl-;
(2)若要在铁制品上镀一定厚度的Ag,Y为Ag,发生氧化反应,电极方程式为Ag-e-=Ag+,电解质为硝酸银,溶液浓度不变,故答案为:Ag-e-=Ag+;不变;
(3)氯气的物质的量为:n(Cl2)=
| 1.12L |
| 22.4L/mol |
| m |
| n |
| 3.2g |
| 0.05mol |
点评:本题考查学生电解池的工作原理知识,为实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强难度较大,对训练学生良好地思维品质以及知识的严密性有较好的帮助,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
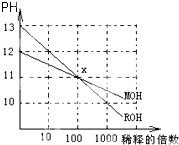 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
含 2molAlCl3的溶液与NaOH溶液反应得1mol沉淀,则消耗 NaOH可能是( )
| A、1 mol |
| B、3 mol |
| C、5 mol |
| D、7 mol |
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )

| A、a电极是负极 |
| B、电子从b电极流向a电极 |
| C、在电池工作中,a电极附近pH值降低 |
| D、b电极的电极反应为:4OH--4e-═2H2O+O2↑ |
下列说法中,错误的是( )
| A、化学反应必然伴随发生能量变化,其能量变化主要是由化学键变化引起的 |
| B、化学反应中能量变化的大小与反应物的质量多少无关 |
| C、101kPa下,1mol的纯物质完全燃烧生成稳定的氧化物时的反应热叫燃烧热 |
| D、酸碱稀溶液中和生成1mol水时的反应热叫中和热 |
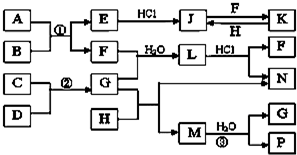 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).