题目内容
某有机物A 7.4g与足量CuO共热后,所得气体产物依次通过盛有浓H2SO4和碱石灰的仪器,两仪器分别增重9g、17.6g;同温同压,A蒸汽的密度是H2的37倍,则能够与钠反应放出H2的A的同分异构体的数目为(不考虑立体异构)( )
| A、8 | B、6 | C、4 | D、2 |
考点:同分异构现象和同分异构体
专题:
分析:根据浓硫酸、碱石灰的装置的质量计算出有机物燃烧生成水、二氧化碳的物质的量,根据A蒸汽与氢气的相对密度计算出A的摩尔质量,然后计算出7.4gA的物质的量,根据质量守恒计算出7.4gA中含有氧元素的质量、物质的量,从而确定A的分子式,再根据有机物能够与钠反应确定其含有的官能团,最后确定其同分异构体数目.
解答:
解:浓硫酸增重的为水的质量,则n(H2O)=
=0.5 mol,
碱石灰增重的为二氧化碳的质量,则n(CO2)=
=0.4 mol
A蒸汽的密度是H2的37倍,则A的摩尔质量为:2g/mol×37=74g/mol,
7.4gA的物质的量为:n(A)=
=0.1 mol,
7.4gA中含有氧元素的物质的量为:n(O)=
=0.1 mol,
该有机物分子中含有C、H、O原子数目为:
=4、
=10、
=1,
,则有机物的分子式为C4H10O,
能与Na反应生成H2的是醇,该有机物为丁醇,
丁基有4种同分异构体,所以丁醇也有4种同分异构体:CH3CH2CH2CH2OH、CH3CHOHCH2CH3、(CH3)3COH、(CH3)2CHOHCH3,
故选C.
| 9g |
| 18g/mol |
碱石灰增重的为二氧化碳的质量,则n(CO2)=
| 17.6g |
| 44g/mol |
A蒸汽的密度是H2的37倍,则A的摩尔质量为:2g/mol×37=74g/mol,
7.4gA的物质的量为:n(A)=
| 7.4g |
| 74g/mol |
7.4gA中含有氧元素的物质的量为:n(O)=
| 7.4g-0.5mol×2×1g/mol-12g/mol×0.4mol |
| 16g/mol |
该有机物分子中含有C、H、O原子数目为:
| 0.4mol |
| 0.1mol |
| 0.5mol×2 |
| 0.1mol |
| 0.1mol |
| 0.1mol |
,则有机物的分子式为C4H10O,
能与Na反应生成H2的是醇,该有机物为丁醇,
丁基有4种同分异构体,所以丁醇也有4种同分异构体:CH3CH2CH2CH2OH、CH3CHOHCH2CH3、(CH3)3COH、(CH3)2CHOHCH3,
故选C.
点评:本题考查了有机物分子式、结构简式的计算、同分异构体的求算,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确同分异构体数目的求算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验基本操作,主要是出于实验安全考虑的是( )
| A、点燃可燃性气体前验纯 |
| B、气体实验装置在实验前进行气密性检查 |
| C、胶头滴管不能交叉使用 |
| D、实验剩余的药品不能放回原试剂瓶 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA |
| B、精炼铜过程中阳极减轻6.4g时,电路中转移电子数等于0.2NA |
| C、2gD216O中含中子、质子、电子数目均为NA |
| D、标准状况下,11.2L NO和O2的混合气体所含有的分子数为0.5 NA |
分子式为C4H9Cl的同分异构体共有( )种.(不考虑立体异构)
| A、4种 | B、8种 | C、2种 | D、3种 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、100mL0.2mol?L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D、电解精炼铜时,阳极减少6.4g,则转移电子数一定是0.2NA |
下列物质属于非电解质的是( )
| A、HNO3 |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |
用0.100mol?L-1的盐酸滴定10ml 0.100mol?L-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05mol?L-1 NaHCO3的pH约为8.3,下列说法不正确的是( )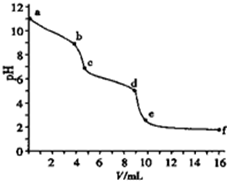

| A、以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml |
| C、溶液pH=7(c点),碳酸钠完全转化为NaCl |
| D、ce段对应溶液中CO2与NaHCO3共存 |
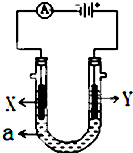 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: