题目内容
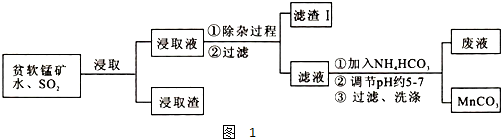
某研究性学习小组在网上收集到如下信息:以贫软锰矿和有色金属冶炼厂的SO2废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为MnO2和少量Fe2O3、SiO2、Al2O3等杂质.工艺流程如图1:
已知:有关氢氧化物沉淀pH对应表
请回答:
(1)在浸出液除杂过程中需通入适量空气并调节溶液的pH到5.0~5.5,沉淀部分杂质离子,此时滤渣I中主要含有 (填化学式).
(2)影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质MnS2O6造成锰损失.温度对浸锰率的影响见图2、图3.
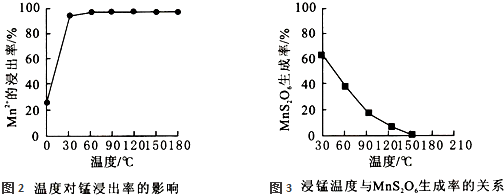
为了提高锰的浸出率,请选择合适的条件 .(填序号)
a.30℃~120℃b.150℃~155℃c.180℃以上
(3)在滤液中加入NH4HCO3生成MnCO3的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ,从废液中分离出该副产物的操作是蒸发浓缩、 .若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 .
(4)现有含锰质量分数为20%的贫锰矿1吨,若按照上述工艺锰的产率为82.5%,最终获得碳酸锰的质量 .

已知:有关氢氧化物沉淀pH对应表
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化铝 | 3.3 | 5.2 |
| 氢氧化亚铁 | 7.6 | 9.6 |
(1)在浸出液除杂过程中需通入适量空气并调节溶液的pH到5.0~5.5,沉淀部分杂质离子,此时滤渣I中主要含有
(2)影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质MnS2O6造成锰损失.温度对浸锰率的影响见图2、图3.

为了提高锰的浸出率,请选择合适的条件
a.30℃~120℃b.150℃~155℃c.180℃以上
(3)在滤液中加入NH4HCO3生成MnCO3的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式
(4)现有含锰质量分数为20%的贫锰矿1吨,若按照上述工艺锰的产率为82.5%,最终获得碳酸锰的质量
考点:制备实验方案的设计,物质分离、提纯的实验方案设计
专题:
分析:由流程可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+,浸取渣为SiO2,结合表格数据可知,除杂若使用氢氧化钠溶液,会使铝离子反应生成偏铝酸根离子,无法生成沉淀,锰离子与氢氧根离子反应生成氢氧化锰沉淀;铝离子完全沉淀时溶液的pH=5.2,铁离子完全沉淀时溶液pH=3.2,所以调节溶液的最小pH为5.2;结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,过滤得到的滤液中含硫酸锰,加碳酸氢铵反应生成碳酸锰,以此来解答.
解答:
解:(1)pH到5.0~5.5,沉淀部分杂质离子,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3;
(2)副反应为MnSO4+SO2 MnS2O6,温度选择不合理时会产生杂质MnS2O6造成锰损失,根据图象知,温度越高,MnS2O6的生成率越低,所以该反应的正反应是放热反应,焓变小于△H<0;当温度为 150℃时,MnS2O6的生成率为0,故选温度为150℃,故答案为:b;
MnS2O6,温度选择不合理时会产生杂质MnS2O6造成锰损失,根据图象知,温度越高,MnS2O6的生成率越低,所以该反应的正反应是放热反应,焓变小于△H<0;当温度为 150℃时,MnS2O6的生成率为0,故选温度为150℃,故答案为:b;
(3)滤液与NH4HCO3生成MnCO3的同时还可以获得一种作为肥料的副产物为硫酸铵,该反应为2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O,从废液中分离出该副产物的操作是蒸发浓缩、冷却结晶、过滤,蒸发需要酒精灯、蒸发皿、玻璃棒,过滤需要漏斗、烧杯,
故答案为:2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O;冷却结晶、过滤;漏斗、烧杯;
(4)含锰质量分数为20%的贫锰矿1吨,则Mn的物质的量为1000kg×20%=200kg,由Mn~MnCO3可知,生成MnCO3的质量为200kg×82.5%×
=345kg,
故答案为:345kg.
(2)副反应为MnSO4+SO2
 MnS2O6,温度选择不合理时会产生杂质MnS2O6造成锰损失,根据图象知,温度越高,MnS2O6的生成率越低,所以该反应的正反应是放热反应,焓变小于△H<0;当温度为 150℃时,MnS2O6的生成率为0,故选温度为150℃,故答案为:b;
MnS2O6,温度选择不合理时会产生杂质MnS2O6造成锰损失,根据图象知,温度越高,MnS2O6的生成率越低,所以该反应的正反应是放热反应,焓变小于△H<0;当温度为 150℃时,MnS2O6的生成率为0,故选温度为150℃,故答案为:b;(3)滤液与NH4HCO3生成MnCO3的同时还可以获得一种作为肥料的副产物为硫酸铵,该反应为2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O,从废液中分离出该副产物的操作是蒸发浓缩、冷却结晶、过滤,蒸发需要酒精灯、蒸发皿、玻璃棒,过滤需要漏斗、烧杯,
故答案为:2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O;冷却结晶、过滤;漏斗、烧杯;
(4)含锰质量分数为20%的贫锰矿1吨,则Mn的物质的量为1000kg×20%=200kg,由Mn~MnCO3可知,生成MnCO3的质量为200kg×82.5%×
| 115 |
| 55 |
故答案为:345kg.
点评:本题考查制备实验方案的设计,为高频考点,把握流程中混合物分离提纯、除杂及发生的反应为解答的关键,侧重分析、实验、推断及计算能力的综合考查,题目难度中等.

练习册系列答案
相关题目
下列过程属于熵增加的是( )
| A、一定条件下,水由气态变成液态 |
| B、Ag+(aq)+Cl-(aq)=AgCl(s) |
| C、4NO2(g)+O2(g)═2N2O5 (g) |
| D、火柴盒中的火柴散落到地上 |
具有下列分子式的一溴代烷中,水解后产物在红热铜丝催化下,最多可被空气氧化生成4种不同的醛的是( )
| A、C4H9Br |
| B、C5H11Br |
| C、C6H13Br |
| D、C7H15Br |
下列实验基本操作,主要是出于实验安全考虑的是( )
| A、点燃可燃性气体前验纯 |
| B、气体实验装置在实验前进行气密性检查 |
| C、胶头滴管不能交叉使用 |
| D、实验剩余的药品不能放回原试剂瓶 |
下列物质属于非电解质的是( )
| A、HNO3 |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |
 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种. 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: